专题亮点 | 事件驱动显微成像:生物活体成像新前沿
为了精准地揭示生命的基本运行机制,生物活体成像必须在尽可能接近生命体自然状态的条件下,对样本进行持续而细致的观察与分析。然而,每个样本所能承受的光子剂量是有限的。在此背景下,事件驱动显微镜凭借其更为温和、高效且智能化的成像方式,正逐步成为生物成像领域的重要技术手段,展现出广阔的应用前景。
《激光与光电子学进展》于2025年18期推出“先进生物医学光学诊断技术”专题,中国科学院上海光学精密机械研究所何飞团队发表的“事件驱动显微成像:生物活体成像新前沿”一文,系统回顾了这一新兴显微成像技术的独特优势、技术分类与应用现状,深入剖析了该技术当前所面临的局限与挑战,并展望了其在揭示复杂生命活动机制及推动精准医疗领域中所蕴含的巨大应用前景。
官网链接:余晨晖, 朱冠熠, 何飞. 事件驱动显微成像:生物活体成像新前沿(特邀)[J]. 激光与光电子学进展, 2025, 62(18): 1817010.
人类对生命基本构造的深入探索,始终与显微成像技术的演进密不可分。自16世纪问世以来,光学显微镜便成为科研人员揭示生命奥秘、探索生物结构与运作机制不可或缺的利器,在当今分子和细胞生物学、生物组织工程等多个生命科学领域中占据举足轻重的地位。然而,受限于样本所能承受的光子预算,传统显微镜在实现生物过程长期高分辨率观测方面面临严峻挑战。为应对这一难题,科研人员不断努力,致力于开发更为智能与温和的显微成像系统。例如,采用更为柔和的照明策略以降低光毒性和光漂白效应;通过多种成像模式之间的智能切换,以灵活适应多样化的成像需求;同时,借助基于事件的高灵敏度传感器,实现对微弱信号的精准捕捉等。这一系列以“事件”为触发点、驱动成像系统动态优化的技术(图1),统称为“事件驱动”显微成像技术[1-4]。该技术依托光学显微镜,实现对细胞与组织的实时动态观察与分析,并结合高速图像采集与处理手段,在活体样本中捕捉并记录瞬息万变的生物事件,从而揭示其结构、功能及其复杂相互作用的深层信息。
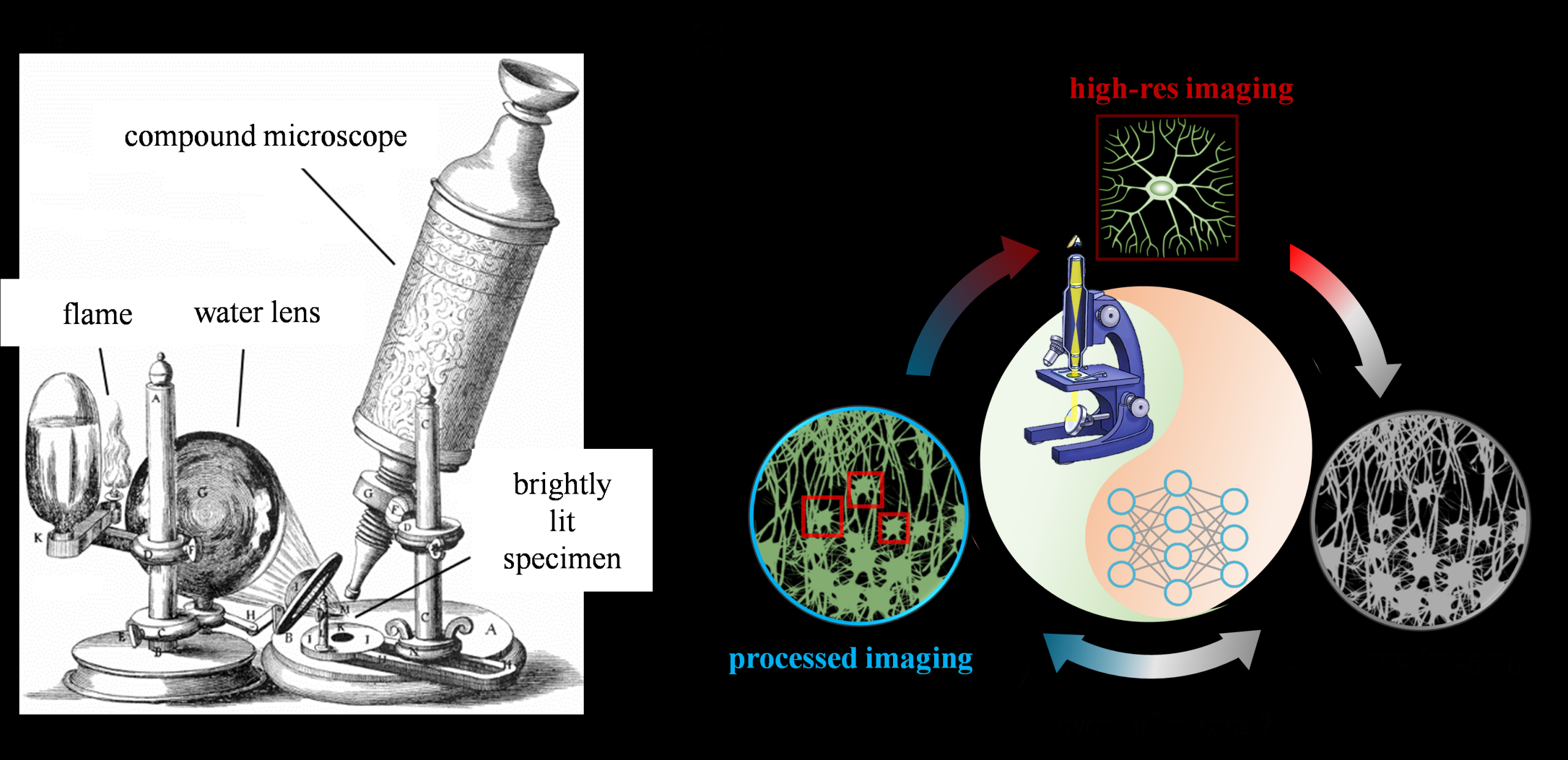
图1 传统光学显微镜与事件驱动显微镜的工作原理对比示意图。(a)早期传统光学显微镜的构造;(b)事件驱动显微镜的工作流程
2.1 事件驱动的光照系统
在光照系统方面,传统照明将整个视场均匀照亮,这种缺乏针对性的光照方式往往导致不必要的光漂白和光毒性,影响成像质量与样本活性。而事件驱动的光照系统则以样本光学特性与形态变化为触发事件,通过实时反馈控制机制,精准调节激发光的强度、波长以及空间分布,从而显著降低光损伤与光漂白效应,同时有效提升成像的信噪比与分辨率。该技术已被广泛应用于结构光照明显微镜(SIM)、受激发射损耗(STED)显微镜、以及可逆饱和光学荧光跃迁(RESOLFT)显微镜等多种高分辨率成像技术中(表1)。例如,在STED中传统扫描以固定光功率进行成像,通常采样效率低且光毒性较高,获得的信号微弱;而动态强度最小值(DyMIN)扫描通过其动态自适应采样的特性,降低了光损伤,并优化了光子利用效率(图2)。
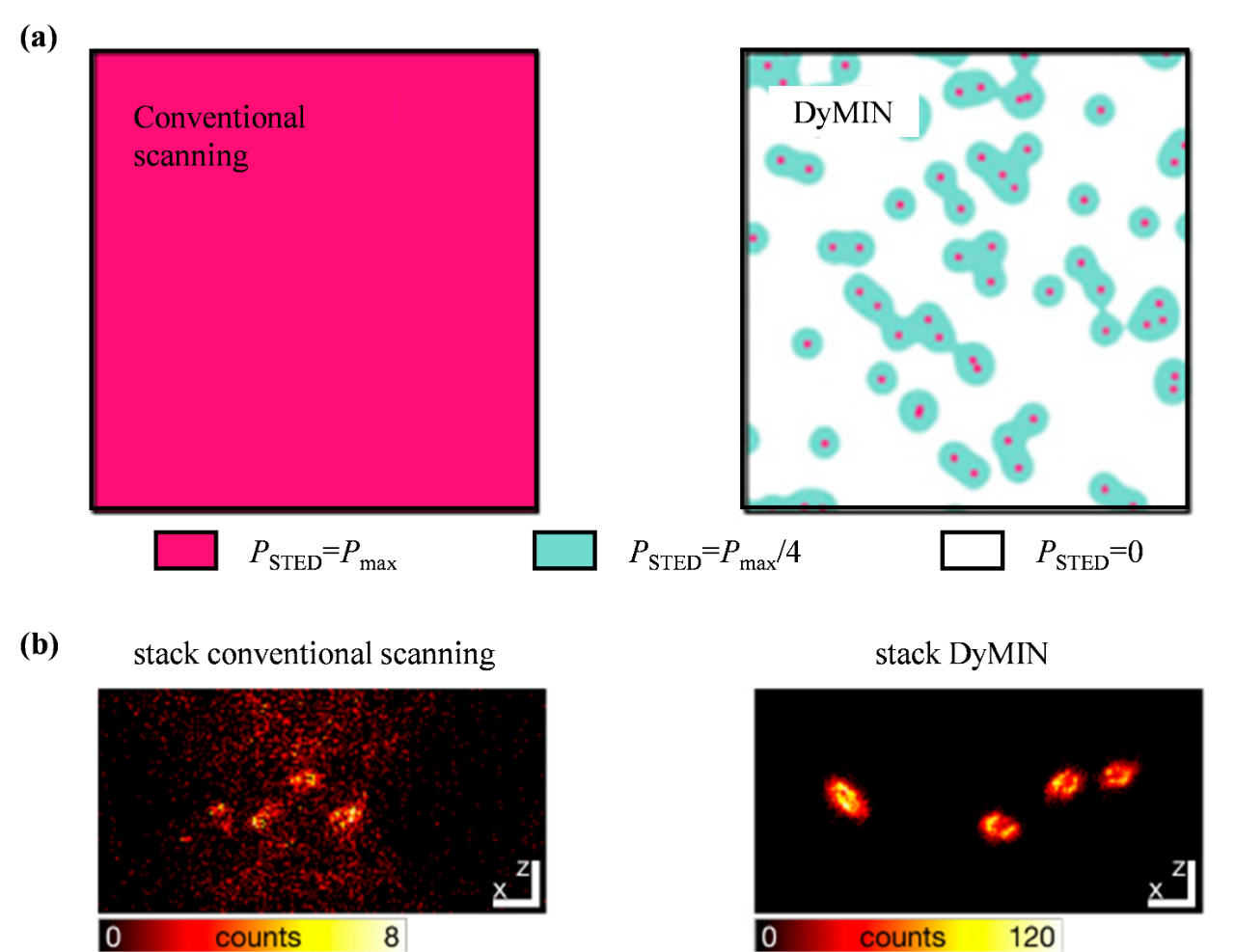
图2 事件驱动光照的STED[5]。(a)传统扫描与事件驱动光照系统 DyMIN扫描施加光功率的对比;(b)传统照明与事件驱动的光照系统在STED中对小鼠精子轴突中的微管成像对比

2.2 事件驱动的成像模式
在成像模式方面,传统的单一模式显微镜往往难以在时间分辨率与空间分辨率之间取得平衡,常常需要在二者之间做出权衡。而事件驱动的成像模式则巧妙融合多种成像技术,根据不同的成像阶段和实时需求,灵活切换成像策略,从而实现更卓越的成像表现。在初始预成像阶段,系统可适度降低时空分辨率与图像质量,以延长观测时间,捕捉更为广泛的生物活动过程。随后,借助先进的图像分析算法,系统能够自动识别并精准定位感兴趣的生物事件。一旦目标被检测到,研究人员便可依据其特性及所需的成像精度,启用更为精细且复杂的成像方案,从而获取高分辨率、高针对性的图像数据。
如图3所示,对神经活动的高精度探测要求同时具备卓越的时间分辨率与空间分辨率。尽管STED技术在空间分辨率方面表现出色,却难以精准捕捉特定神经事件的发生时刻,限制了其在动态过程中的应用。此外,实现超分辨率成像往往需要施加高强度的光照,这不仅可能引发光毒性,也进一步限制了成像的持续时间。事件驱动的STED(etSTED)技术则巧妙融合了宽场成像的高时间分辨率与STED成像的超高空间分辨率优势,在宽场模式下实时监测海马体神经元中局部钙离子活性事件的发生,并在检测到事件后不超过40毫秒的极短时间内迅速切换至STED成像模式,从而实现了对钙信号传导过程中突触蛋白动态重排过程的纳米级、高精度、实时可视化追踪。
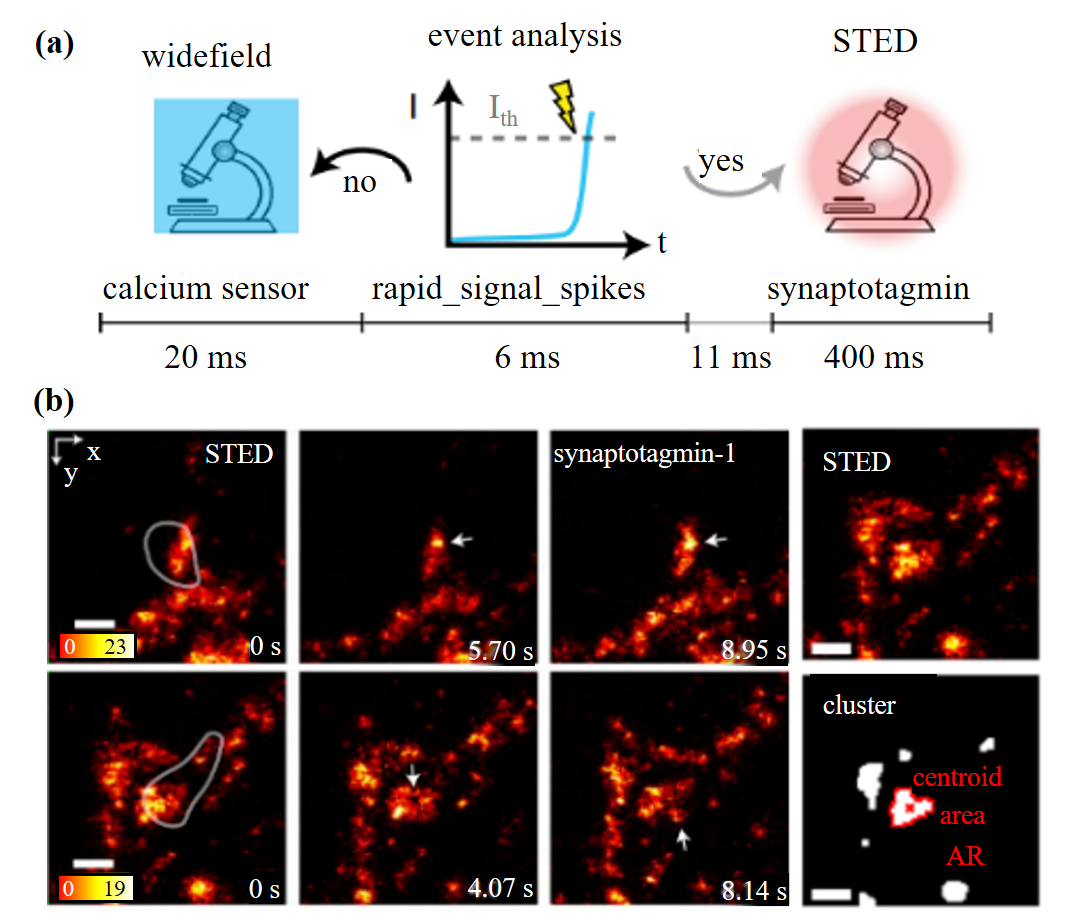
图3 etSTED对神经元活动成像[6]。(a)一个宽场帧的实验时间线;(b)两个检测到的事件位置处的2.5 Hz etSTED时间序列及突触囊泡簇分析
2.3 事件驱动的探测相机
在探测器方面,传统相机受限于采样频率与曝光时间等因素,当被摄物体处于高速运动状态时,往往会出现数据丢失或运动模糊的现象。此外,在极端光照条件下,无论是过高的曝光强度还是过低的光照水平,传统相机都会“失明”,无法有效捕捉图像信息。而事件相机的每个像素均配备独立的光电传感模块,当该像素的亮度变化超过预设阈值时,便会即时生成并输出事件数据。其具备低延迟、高动态范围、低功耗及高时间分辨率等显著优势。更重要的是,通过“按需记录”的工作机制,大幅减少了无效曝光,相较于传统相机,可节省90%以上的光剂量。在显微成像领域,事件驱动传感器(EBS)为突破传统帧式传感器的固有局限提供了全新的技术路径。如图4所示,在DNA点积累纳米拓扑成像实验中,当标记分子浓度较高时,sCMOS因信号过载而无法分辨微管结构,而EBS则通过在时间域上分离信号,成功实现了24 nm的超高分辨率成像,有效消除了图像中的重叠伪影,显著提升了成像质量。
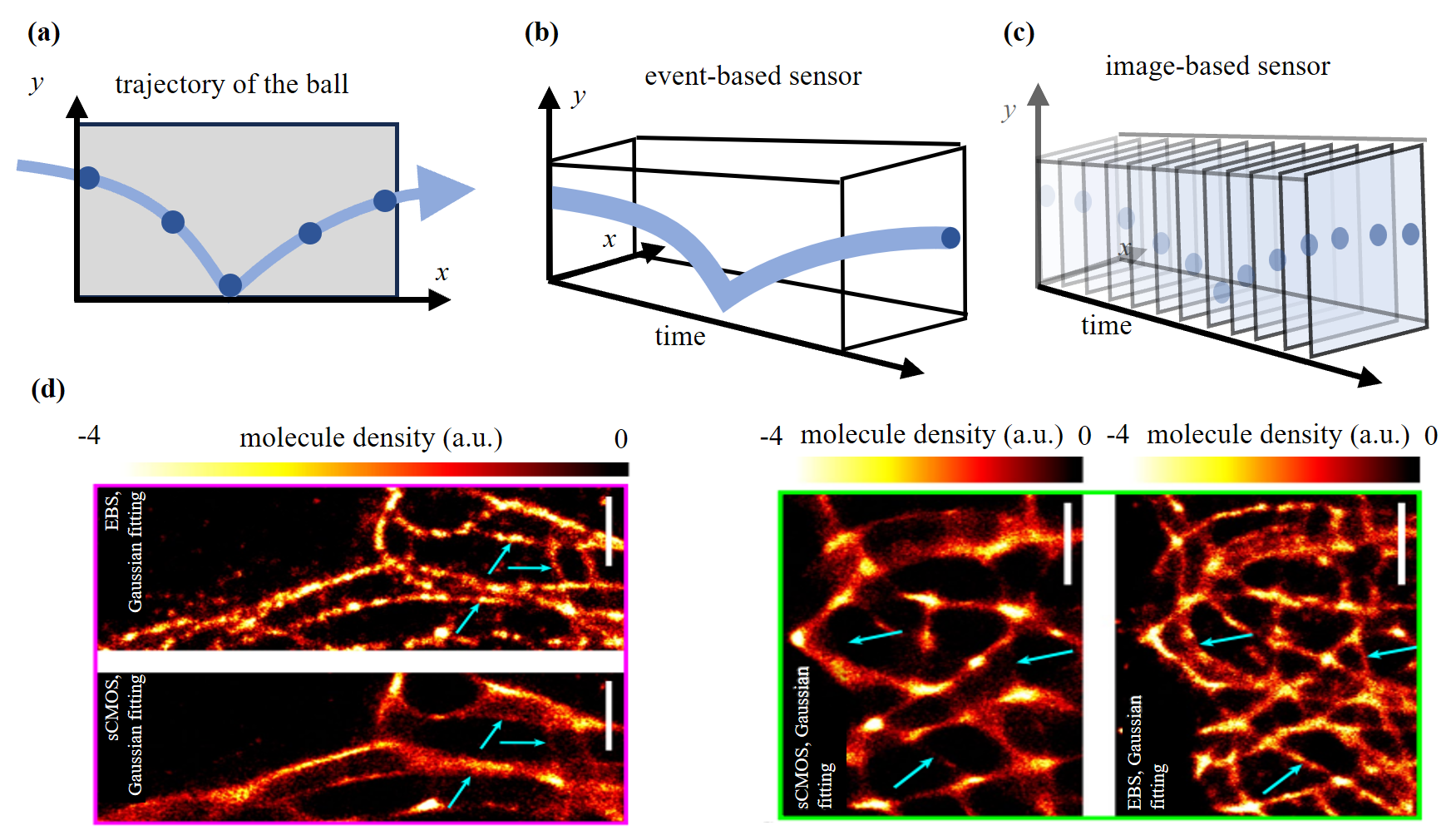
图4 事件相机的工作原理及应用[3]。(a)运动球在xy平面的轨迹;(b)事件相机以高时间分辨率捕获小球运动轨迹的示意图;(c)传统的基于帧的图像传感器以一定的帧速率确定的输出图像;(d)sCMOS和事件相机的单分子定位显微(SMLM)图像
事件驱动活体显微成像技术融合了先进的图像识别算法和反馈控制机制,突破了传统技术中因光子预算受限而导致的时间与空间分辨率相互制约的瓶颈,已在高时空分辨神经活动探测、癌细胞迁移追踪,以及纳米医学和精准药物设计等领域展现出显著的研究潜力与成果。未来借助前沿的光学技术与智能化图像处理算法,这一系统将能够精准捕捉细胞与组织内部的微观结构,为科研人员提供详实而全面的数据支持,助力揭示复杂生命过程的深层机制。与此同时,系统的功能将变得更加灵活多样,支持多种模块的集成应用。除生物荧光成像外,基于新物理原理(如光声效应、谐波效应、拉曼散射等)甚至是跨越多种生物信息模态的事件驱动显微技术或将应运而生。这些新型设备不仅具备卓越的灵敏度与分辨率,还可摆脱对荧光染料或标记物的依赖,从而有效保护样本的原始状态,降低外界干扰,提升观测结果的真实性与可靠性。随着这一技术逐渐普及并应用于临床实践,它有望为医学诊断、治疗以及新药开发等领域带来革命性变革。
[1] Pinkard H, Baghdassarian H, Mujal A, et al. Learned adaptive multiphoton illumination microscopy for large-scale immune response imaging[J]. Nature Communications, 2021, 12(1):1916.
[2] Mahecic D, Stepp W L, Zhang C, et al. Event-driven acquisition for content-enriched microscopy[J]. Nature Methods, 2022, 19(10):1262-1267. [3] Cabriel C, Monfort T, Specht C G, et al. Event-based vision sensor for fast and dense single-molecule localization microscopy[J]. Nature Photonics, 2023, 17(12):1105–1113. [4] Shi Y, Tabet J S, Milkie D E, et al. Smart lattice light-sheet microscopy for imaging rare and complex cellular events[J]. Nature Methods, 2024, 21(2):301-310. [5] Heine J, Reuss M, Harke B, et al. Adaptive-illumination STED nanoscopy[J]. Proceedings of the National Academy of Sciences, 2017, 114(37):9797-9802. [6] Alvelid J, Damenti M, Sgattoni C, et al. Event-triggered STED imaging[J]. Nature Methods, 2022, 19(10):1268-1275.免责声明:本文旨在传递更多科研资讯及分享,所有其他媒、网来源均注明出处,如涉及版权问题,请作者第一时间联系我们,我们将协调进行处理,最终解释权归旭为光电所有。