重磅突破! LIFT显微镜:3P成像视场扩大10倍以上,深层脑区从此一览无余!
这篇文献是来自波士顿大学Benjamin B. Scott和Jerome Mertz课题组合作在2025年3月发表的预印本《Three-photon population imaging of subcortical brain regions》
doi:https://doi.org/10.1101/2025.03.21.644611
pmc地址:https://pmc.ncbi.nlm.nih.gov/articles/PMC11957121/

文献摘要
记录深层神经回路中大量细胞群体的活动对于理解大脑功能至关重要。三光子(3P)成像是一项新兴技术,它允许对皮层下脑结构的结构和功能进行成像。然而,组织加热的增加以及 3P 成像固有的低重复率光源限制了视场(FOV)到≤0.3 毫米 2 。在这里,我们介绍一台具有>3 毫米 2 视场的宽视场三光子(LIFT)显微镜。LIFT 结合了高数值孔径(NA)优化的采样,使用定制的扫描模块,以及基于深度学习的去噪,以实现深层脑区的群体成像。我们展示了在小鼠大脑中从 CA1、周围的白质以及相邻的皮质深层中>1500 个细胞的非侵入性钙成像,并在大鼠皮质 1.2 毫米深度处展示了高信噪比的群体成像。LIFT 显微镜使用所有现成的组件构建,并允许灵活选择成像规模和速率。
-
研究的背景是什么
-
记录深层神经回路中大量细胞群体的活动对于理解大脑功能至关重要。亚皮层脑结构和深层皮层的功能成像是一个重要的研究领域。
-
-
之前研究已经做过什么了
-
双光子(2P)显微镜已经彻底改变了活体脑成像技术,能够非侵入性地对散射脑组织中的神经活动进行亚细胞分辨率记录,深度可达数百微米,适用于小鼠皮层的多层成像。已经开发出几种大视野 2P 系统用于成像大型神经元群体。三光子(3P)显微镜作为一种新兴的神经成像技术,可以进入大脑更深的层次,包括小鼠海马体。
-
-
领域未解决的问题是什么?
-
尽管 3P 成像已被证明有用,但由于组织加热增加以及 3P 成像固有的低重复率光源,在 1 毫米深度下的成像视野(FOV)一直受限(面积 ≤ 0.3 mm²)。高脉冲能量需求导致使用低重复率激发光源,这限制了数据采集速率,从而限制了与钙成像兼容速率下的成像焦点数量和 FOV 大小。增加重复率和激发功率以保持脉冲能量的方法会导致激发功率超出通常接受的组织加热限制。
-
-
作者是如何解决问题的
-
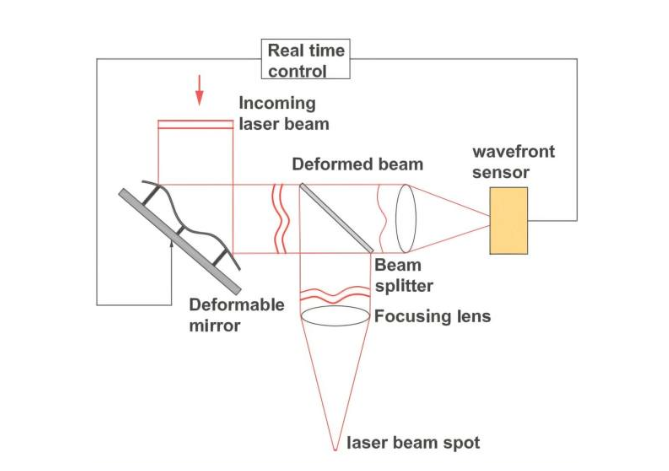
作者提出了一种大成像视野三光子(LIFT)显微镜。LIFT 结合了高数值孔径(NA)优化采样和高速扫描模块。他们设计 LIFT 以尽可能稀疏地采样焦平面,同时不欠采样细胞(使用4um的间隔采样),并以允许去噪后解析事件的最低帧速率进行记录 。他们构建了一个定制的扫描模块,该模块在允许最大灵活性的成像比例和速率的同时,在大 FOV 上执行优化空间采样。通过两个x galvo relay来增加扫描角度并使扫描速度加倍 ,并实施了回转成像 (imaging on turnaround) 技术,以在给定帧速率下最大化 FOV 。此外,他们使用自监督去噪算法 DeepCAD-rt 对功能成像数据进行去噪,以增强信噪比(SNR)和可解析活动细胞的数量 。值得注意的是,LIFT 是用所有市售组件构建的,使其更易于复制和实现。
-
-
研究主要结果
-
显著扩大了 3P 成像的视野和细胞数量:LIFT 实现了 >3 mm² 的 FOV,是将 3P 功能成像在 1 毫米深度处 FOV 尺寸提高了 10 倍,并将记录到的神经元数量提高了 15 倍,远超以往的 3P 系统。使用Nikon 16x,0.8 NA物镜,可以获得2mm×2mm 4.7Hz的FOV,1.65mm×2mm 6Hz的FOV,1.65mm×0.45mm 27Hz的FOV。作者展示了在小鼠大脑中进行非侵入性钙成像,覆盖 CA1、周围白质和相邻深层皮层的>1500 个细胞,并在大鼠皮层深度为 1.2 mm 处展示了高信噪比的群体神经元成像。
-
-
研究创新点
-
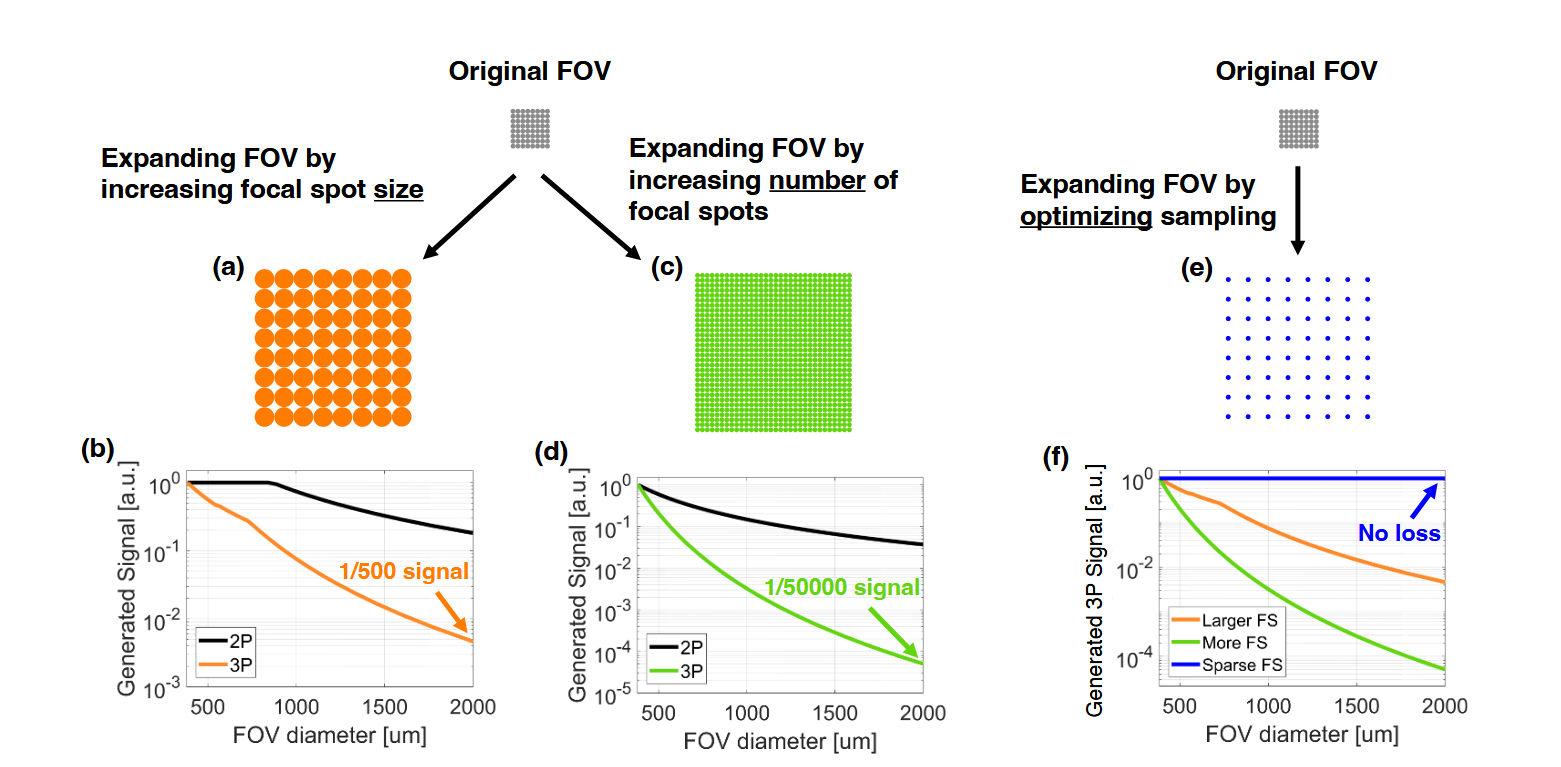
优化采样策略:LIFT 采用了高 NA 优化采样方案,克服了传统方法增加 FOV (比如更大激光焦点、增加每帧焦点成像的焦点数量)会导致的信号快速衰减问题,在扩大 FOV 的同时最大化了 SNR ,并且发现这种方案还能减轻了组织加热,从而可以使用更高的激光功率来成像,获取更好的成像信号。(其实这个方案,在我的理解里是,2mm×2mm的视野,为了足够的分辨率,一般会采用2096×2096像素去采图,但是对于三光子而言,这样采图帧率太慢了,就改为512×512像素去采图,虽然这样分辨率低了,但是大视野的情况下帧率就能提高了,没有激光能量衰减的问题)
-
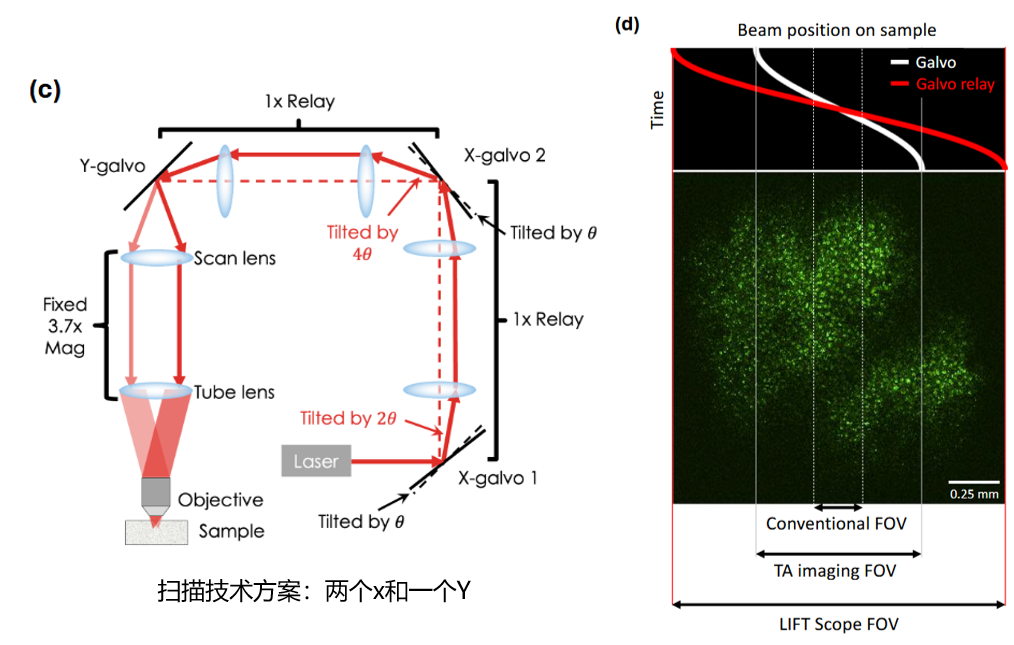
定制扫描模块:使用基于两个x galvo relay的定制扫描模块,通过增加扫描角度和回转成像技术,在保持灵活性的同时实现了大角度、快速扫描,支持大 FOV 3P 成像 。相比DEEPscope使用polygon的扫描方案,该方案能保留galvo扫描的优点,灵活调节视野和帧率。
-
集成深度学习去噪:结合 DeepCAD-RT 去噪算法,显著提高了 SNR 和可检测细胞的数量,提升了成像质量 。
-
使用市售组件构建:整个 LIFT 显微镜系统使用现成的市售组件构建,使其更易于复制和实现。
-
在大鼠中的首次大 FOV 3P 成像:首次在大鼠脑部实现了大 FOV 的 3P 群体成像,为在更大脑模型中研究深层脑区提供了新的工具。
-
作者背景
第一作者:Hadas Frostig
通讯作者
-
Jerome Mertz
-
Benjamin B Scott
Benjamin B Scott
波士顿大学心理与脑科学系助理教授
实验室网站:[Laboratory of Comparative Cognition](https://www.scottcognitionlab.com/)(比较认知实验室)
教育经历:他在芝加哥大学生物学学士学位和麻省理工学院神经科学博士学位。他在普林斯顿大学担任博士后研究员,师从David W. Tank和Carlos Brody
研究方向:结合生物医学和神经行为学,开发和应用新技术(开发新型光学成像系统、动物遗传方法),以研究认知和复杂学习行为的神经基础。
研究方向涉及
-
神经技术开发
-
头戴式显微镜开发
-
-
生物技术开发
-
使用慢病毒制作转基因鸟类
-
-
研究认知神经回路
-
鸣禽的神经迁移和发育(大多数哺乳动物神经再生能力有限)
-
基于推理的决策制定的神经回路:小鼠、大鼠、人类
-
具体工作
-
研究鸣禽的神经迁移和发育(博士在MIT的研究方向)
-
用慢病毒制作转基因鸟类
-
鸣禽在发声学习期间产生的歌唱系统神经元
-
Benjamin B Scott et al. J. Comp. Neurol., 2007. Developmental origin and identity of song system neurons born during vocal learning in songbirds. https://doi.org/10.1002/cne.21296
-
-
在幼年斑胸草雀中发现了一种独特的“漫游式”神经元迁移模式
-
Benjamin B Scott et al. J. Neurosci.: Off. J. Soc. Neurosci., 2012. Wandering neuronal migration in the postnatal vertebrate forebrain. https://doi.org/10.1523/JNEUROSCI.2145-11.2012
-
-
双光子体内成像,观察鸟类新生神经元如何在大脑扩散
-
Naomi R Shvedov et al. Cell Rep., 2024. In vivo imaging in transgenic songbirds reveals superdiffusive neuron migration in the adult brain. https://doi.org/10.1016/j.celrep.2024.113759
-
-
Benjamin B Scott et al. Proc. Natl. Acad. Sci. U. S. A., 2005. Generation of tissue-specific transgenic birds with lentiviral vectors. https://doi.org/10.1073/pnas.0508437102
-
Benjamin B Scott et al. J. Comp. Neurol., 2007. Developmental origin and identity of song system neurons born during vocal learning in songbirds. https://doi.org/10.1002/cne.21296
-
-
显微镜开发
-
机械自愿头部固定系统
-
磁性自愿头部固定系统,允许动物随意地进行固定和脱离,用于成像自由活动大鼠,实现6个月成像
-
P Dylan Rich et al. Nat. Commun., 2024. Magnetic voluntary head-fixation in transgenic rats enables lifespan imaging of hippocampal neurons. https://doi.org/10.1038/s41467-024-48505-9
-
-
头戴式宽视场显微镜:cScope,FOV 7.8 x 4mm,用于成像自由活动大鼠,方案开源
-
Benjamin B Scott et al. Neuron, 2018. Imaging cortical dynamics in GCaMP transgenic rats with a head-mounted widefield macroscope. https://doi.org/10.1016/j.neuron.2018.09.050
-
-
Benjamin B Scott et al. Neuron, 2013. Cellular resolution functional imaging in behaving rats using voluntary head restraint. https://doi.org/10.1016/j.neuron.2013.08.002
-
-
研究基于推理的决策制定的神经回路
-
大鼠运动如何反映证据累积任务中内部决策动态的研究
-
利用在线游戏评估人类证据累积和规则学习的工作
-
Quan Do et al. J. Neurophysiol., 2023. Assessing evidence accumulation and rule learning in humans with an online game. https://doi.org/10.1152/jn.00124.2022
-
-
一种跨物种框架用于研究感知证据累积
-
Sucheta Chakravarty et al. Elife, 2025. A cross-species framework for investigating perceptual evidence accumulation. https://doi.org/10.7554/eLife.105116.1
-
-
Benjamin B Scott et al. Neuron, 2017. Fronto-parietal cortical circuits encode accumulated evidence with a diversity of timescales. https://doi.org/10.1016/j.neuron.2017.06.013
-
Gary A Kane et al. J. Neurophysiol., 2024. Rat movements reflect internal decision dynamics in an evidence accumulation task. https://doi.org/10.1152/jn.00181.2024
-
Rifqi O Affan et al. J. Neurophysiol., 2025. Ramping dynamics in the frontal cortex unfold over multiple timescales during motor planning. https://doi.org/10.1152/jn.00234.2024
-
Jerome C. Mertz
免责声明:本文旨在传递更多科研资讯及分享,所有其他媒、网来源均注明出处,如涉及版权问题,请作者第一时间联系我们,我们将协调进行处理,最终解释权归旭为光电所有。