章永登Nature Methods丨4Pi-SIMFLUX实现全细胞三维2纳米定位精度
本文由论文作者团队投稿

导读
细胞内大分子复合物的精细三维纳米结构,是其行使特定生物学功能的结构基础。单分子定位成像技术(Single-Molecule Localization Microscopy, SMLM)凭借其10–20纳米量级的空间分辨率,已成为探索纳米尺度亚细胞结构的核心工具。然而,一个长期存在的瓶颈在于:由于物镜数值孔径的物理限制,光学系统的点扩散函数(Point Spread Function, PSF)存在固有各向异性,导致3D-SMLM的轴向(深度)分辨率通常劣于横向分辨率2–3倍。为解决此问题而发展的单分子干涉定位成像技术4Pi-SMLM,通过双物镜相干收集荧光,虽将轴向分辨率提升了5–6倍,却也引入了新的各向异性问题,即轴向分辨率优于横向分辨率[1-4]。因此,亟需开发一种能显著提升4Pi-SMLM横向定位精度、最终实现三维各向同性分子级分辨率的方法。
近年来,MINFLUX技术的出现为提升SMLM的定位精度开辟了新途径[5]。它利用甜甜圈状(doughnut-shaped)的照明图案进行位置编码,从而高效提取分子的位置信息。但MINFLUX一次仅能定位单个分子,成像通量较低,且难以兼容高密度标记环境。随后,一系列借鉴其核心思想的改进方案(如SIMFLUX、ROSE与SIMPLE等,统称SIMFLUX)相继被提出[6-8],它们以条纹结构的宽场照明替代环形照明,实现了单分子的并行定位。尽管SIMFLUX在分辨率提升幅度上不及MINFLUX,但其成像通量获得了显著提升,使其更具全细胞成像的应用潜力。
2025年11月20日,西湖大学章永登团队在Nature Methods期刊上发表题为“4Pi-SIMFLUX: 4Pi single-molecule localization microscopy with structured illumination”的研究论文。该工作将SIMFLUX的条纹结构照明与4Pi-SMLM的相干荧光探测相结合,在全细胞内实现了2–3纳米的三维各向同性定位精度,为在分子尺度解析复杂大分子机器的精细结构提供了新的工具。
4Pi-SIMFLUX的系统设计与原理如图1所示。在激发端,系统利用空间光调制器(Spatial Light Modulator, SLM)产生动态条纹结构照明(SIMFLUX模式),对荧光分子进行空间位置编码,从而提升横向(x-y)定位精度。在探测端,通过双物镜相干收集荧光信号并进行四相位干涉成像(4Pi-SMLM模式),保留了超高的轴向(z)定位灵敏度。得益于此集成设计,相较于基于柱面镜散光成像的传统3D-SMLM,4Pi-SIMFLUX在横向定位精度上提升约2倍、轴向定位精度提升约5-6倍,最终实现了三维各向同性的2–3纳米定位精度(图1e-f)。
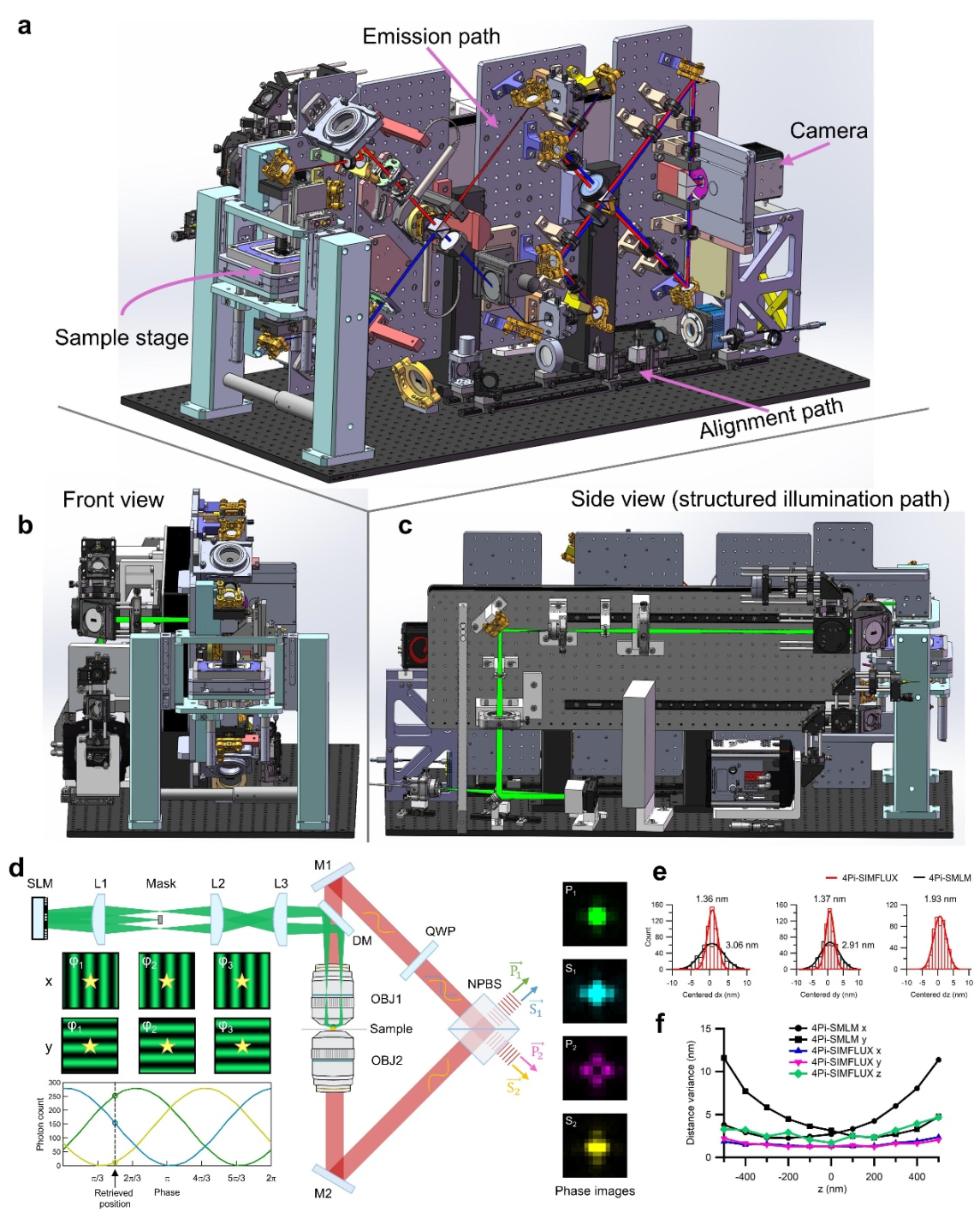
图1:4Pi-SIMFLUX系统原理与验证
为应对真实生物样品的成像挑战,研究团队开发了将ALFA-tag/NbALFA体系与speed-optimized DNA-PAINT技术[9]相结合的标记策略,在减小标记尺寸的同时提高了定位精度和标记密度。在对微管的成像实验中,4Pi-SIMFLUX相较4Pi-SMLM更清晰地解析了多根并行微管的中空结构(图2a-c)。定量分析显示,4Pi-SIMFLUX的横向定位精度(Distance beTWeen Adjacent-Frame Localizations, DAFL)可达1.8纳米,相比4Pi-SMLM的4.0纳米提升约2.2倍(图2d)。傅里叶环相关(Fourier Ring Correlation, FRC)分析同样验证了分辨率的显著增强:4Pi-SIMFLUX的分辨率为6.6纳米,而4Pi-SMLM为13.4纳米(图2e)。此外,对成像过程中持续发光大于10帧的单分子进行统计分析表明,在细胞环境中,4Pi-SIMFLUX可实现约2纳米的三维定位精度(图2f-g),并且相较4Pi-SMLM和3D-SMLM,更清晰地解析出了微管的环状精细结构(图2h)。
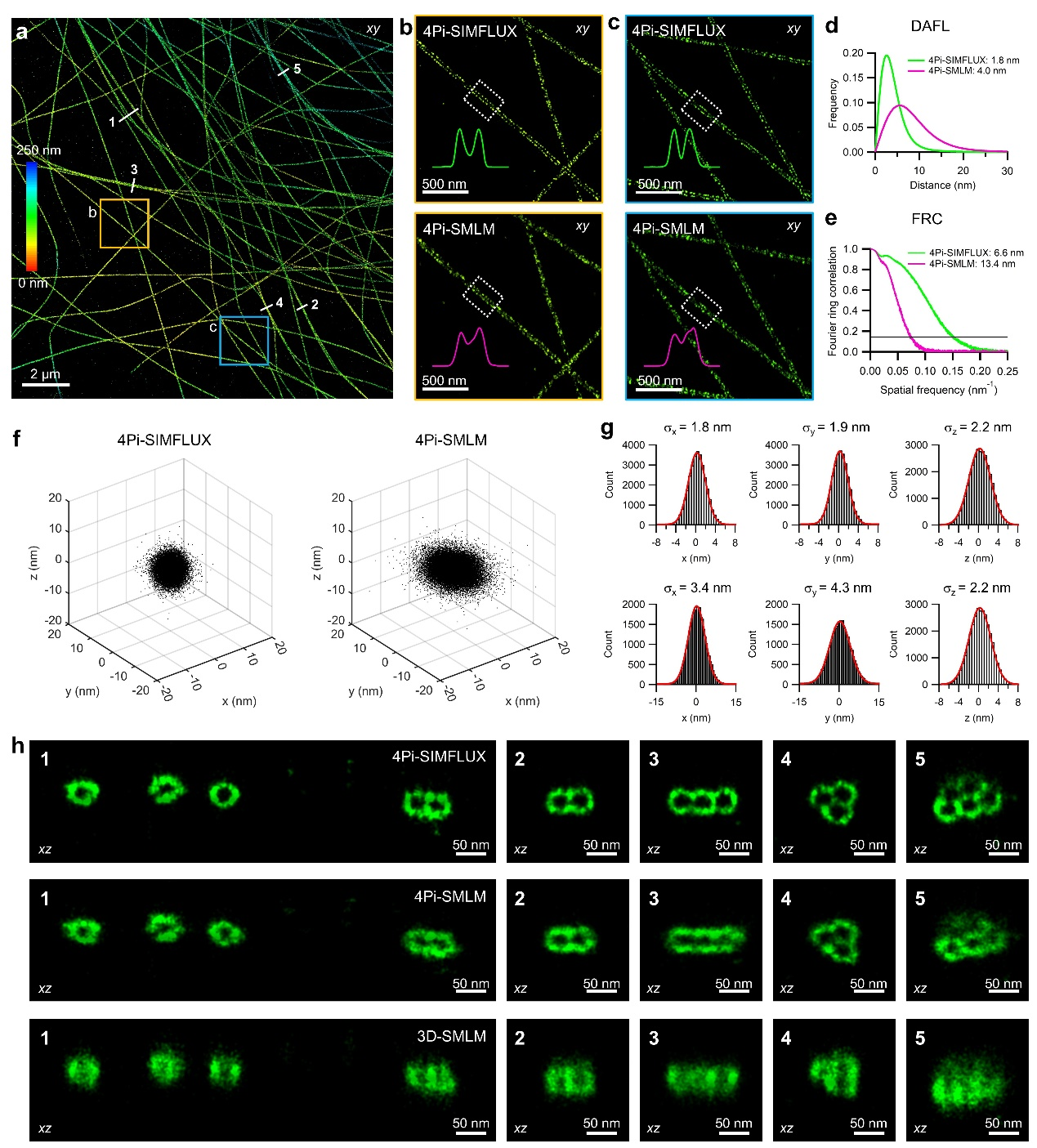
图2:4Pi-SIMFLUX解析微管结构
核孔复合物(Nuclear Pore Complex, NPC)因其精确且规则的结构,是定量超分辨成像中公认的基准模型。其结构蛋白Nup96以八重对称的双环(核质环NR和细胞质环CR)形式排列,每个NPC包含32个Nup96拷贝,相邻分子间的横向距离仅约10纳米。这一间距对包括4Pi-SMLM在内的大多数超分辨技术构成了严峻挑战,超出了其有效分辨极限。目前,解析Nup96蛋白对最有效的方法之一是RESI (Resolution Enhancement by Sequential Imaging)技术[10],它通过累积多个顺序结合事件以获得超高光子数,从而将定位精度提升至埃米级别。在本研究中,4Pi-SIMFLUX凭借其极高的三维定位精度,并结合优化的样品标记策略,获得了与RESI相当的成像质量。该结果证明,在综合考虑标记尺寸和密度等实际生物学约束条件后,4Pi-SIMFLUX能够在细胞内实现优于10纳米的有效三维分辨率(图3),为解析核孔复合物等复杂大分子机器的精细结构提供了强有力的工具。
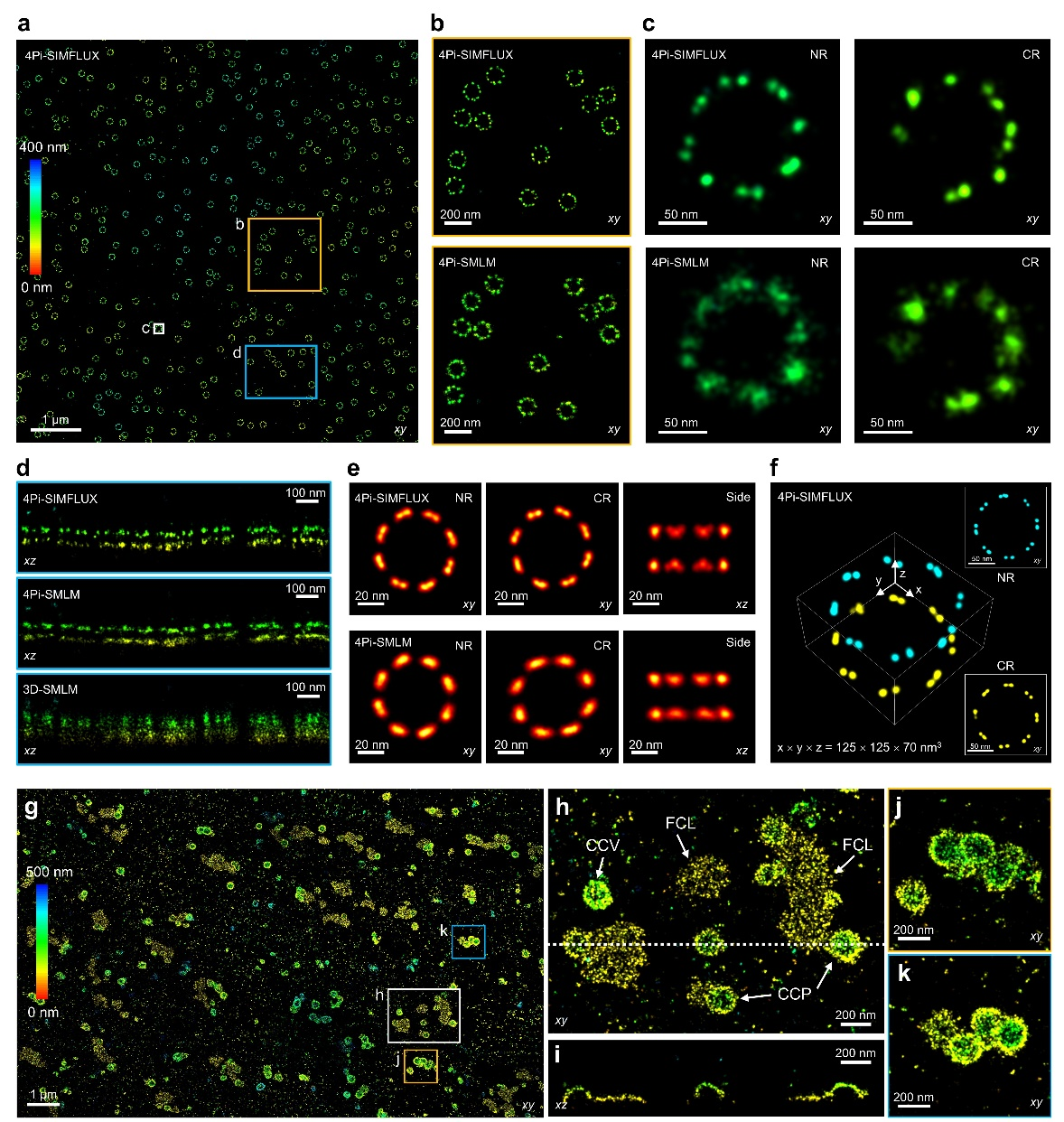
图3:4Pi-SIMFLUX解析核孔复合物与网格蛋白
为进一步拓展系统的应用范围,研究团队将他们于2020年开发的回收荧光分色技术(Salvaged Fluorescence)[1]与4Pi-SIMFLUX进行集成。该设计允许使用单一560纳米激光同时激发Cy3B和AF568两种荧光染料,从而实现同步双色成像。通过结合4Pi-SIMFLUX的超高定位精度与Salvaged Fluorescence技术的低串扰优势,该系统能够在同一样品中同时清晰地解析内质网和微管的中空管状结构(图4),为研究复杂亚细胞结构间的空间关系提供了新的手段。
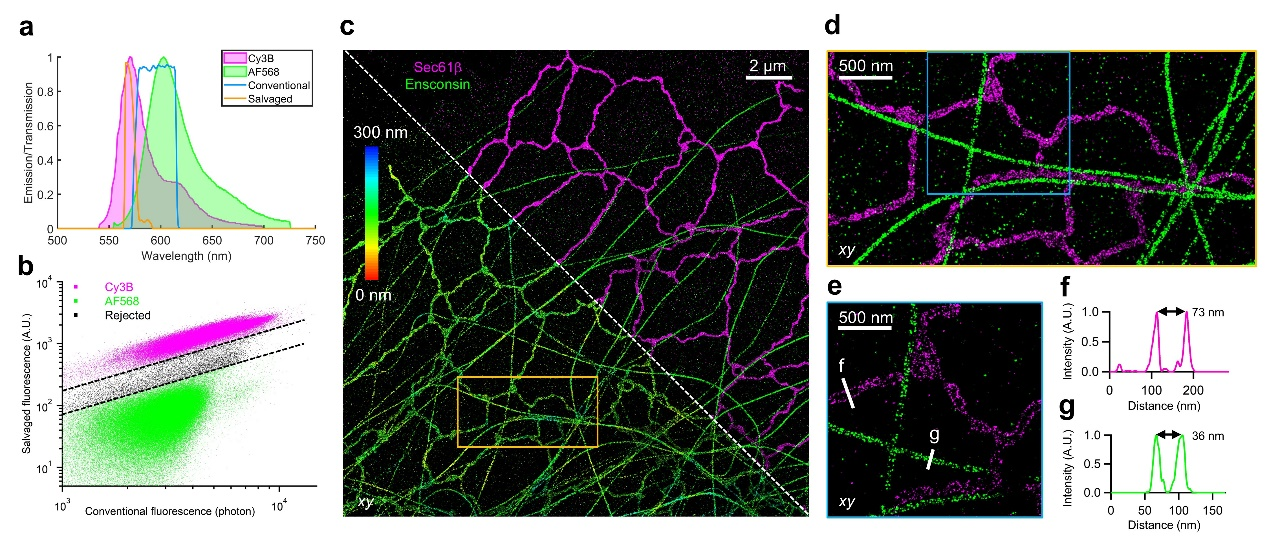
图4:4Pi-SIMFLUX同时双色成像
在成像模式上,本研究首先将speed-optimized DNA-PAINT技术与近全反射(near-TIRF)照明相结合,此配置将4Pi-SIMFLUX的有效成像深度限制在细胞近底部的数百纳米范围内。为了突破这一限制并实现全细胞尺度的三维观测,团队转而采用了改进的Fluorogenic DNA-PAINT技术[11]与高倾斜光片照明(Highly Inclined and Laminated Optical sheet, HILO)模式构成的新策略。该策略将单次光学成像的深度提升至约1.2微米。在此基础上,通过采集轴向多层图像并进行拼接,最终成功重构了线粒体网络及小鼠精母细胞联会复合体等深层结构的全细胞三维超分辨图像(图5)。
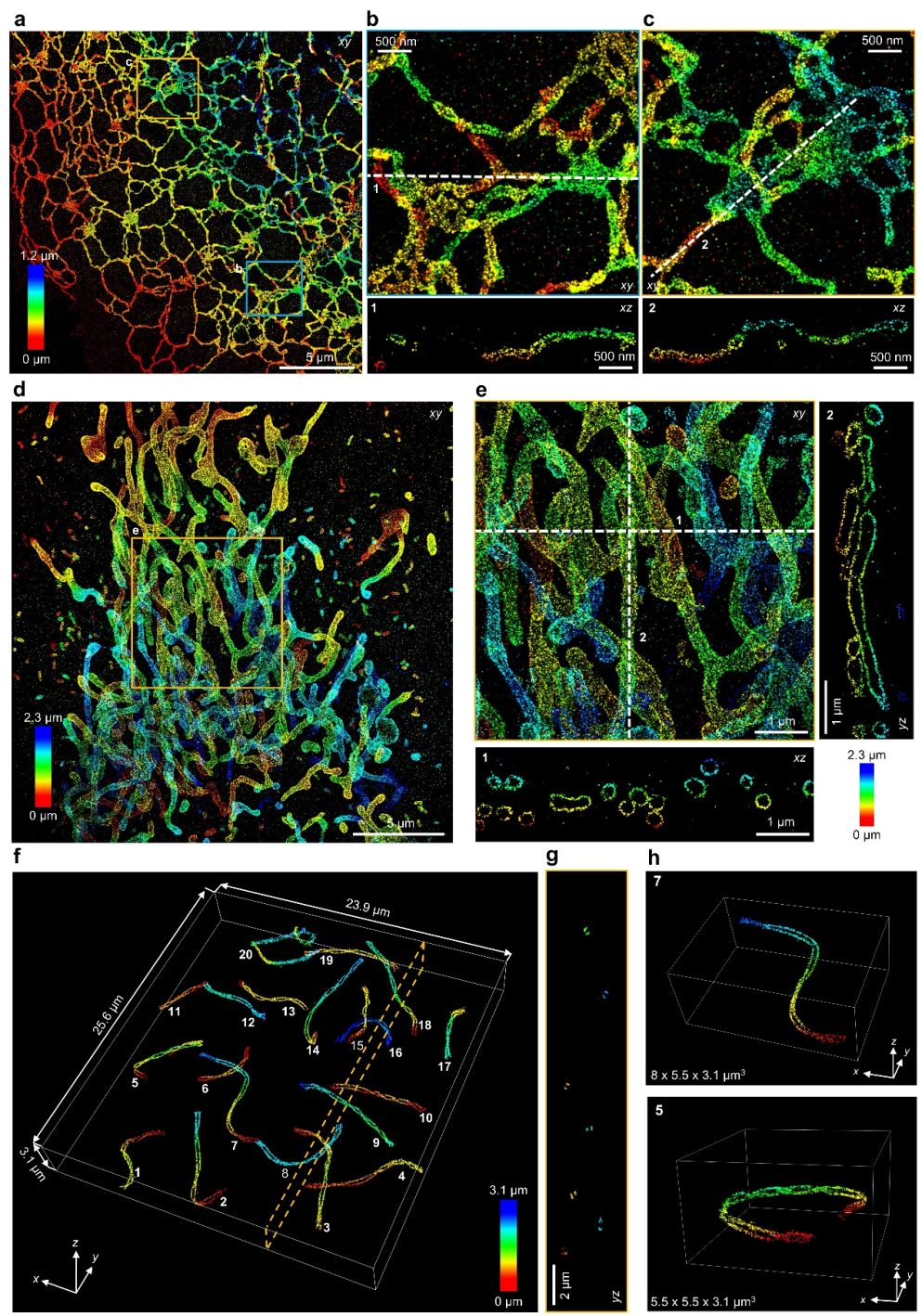
图5:4Pi-SIMFLUX全细胞成像
在此前的工作中,章永登团队与北京大学黄小帅团队/陈良怡团队、重庆邮电大学范骏超团队合作,通过将4Pi显微镜与结构光照明显微镜(Structured Illumination Microscopy, SIM)相结合,开发了活细胞超分辨成像技术4Pi-SIM,首次在活细胞中实现了三维双色各向同性约100纳米的分辨率[12]。本次提出的4Pi-SIMFLUX技术,则在固定细胞样品上将定位精度进一步推进至三维各向同性的2–3纳米。这两套互为补充的4Pi超分辨系统,分别面向活细胞动态与固定细胞精细结构的观测场景,为生命科学研究提供了系统性的三维超高分辨率解决方案。此纳米级别的空间分辨率,将为科学家在分子尺度上探索亚细胞器的精细结构与动态过程带来全新的视角,从而推动重要科学问题的突破与发现。
作者介绍
西湖大学章永登研究员为该论文通讯作者,其团队博士生王倩(与浙江大学联合培养)与西湖实验室助理研究员郑贝博士为共同第一作者。章永登团队博士生于紫荆、黎舒馨、乔渝及科研助理占雅静、代秋阳为本研究做出重要贡献。本工作获得西湖大学俞晓春研究员及其博士生陈琳琳、浙江大学UIUC联合学院林毓研究员及其博士生王旭龙的重要协助与合作,并得到中国科学院生物物理研究所谷陆生研究员、西湖大学谢琦研究员及耶鲁大学Joerg Bewersdorf教授的支持与帮助。
西湖大学章永登团队(https://www.westlake.edu.cn/faculty/yongdeng-zhang.html)长期招收博士后、科研助理及博士研究生。欢迎具有生物医学工程、物理光学、计算机、生物技术、生物化学等相关专业背景的申请者加入。要求具备良好的学习能力、独立工作能力和团队沟通能力。有意者请将个人简历发送至(zhanglab@westlake.edu.cn)。
论文信息
Wang, Q., Zheng, B., Yu, Z. et al. 4Pi-SIMFLUX: 4Pi single-molecule localization microscopy with structured illumination. Nat Methods (2025).
参考文献
免责声明:本文旨在传递更多科研资讯及分享,所有其他媒、网来源均注明出处,如涉及版权问题,请作者第一时间联系我们,我们将协调进行处理,最终解释权归旭为光电所有。