荧光显微镜背景太强怎么办?Nature Methods|北京大学席鹏团队发表高保真背景去除技术Dark sectioning
然而,散焦背景问题一直是荧光显微镜成像的一大阻碍,它会模糊细胞细节,降低图像质量,干扰研究结果的准确性。
2025 年发表于Nature Methods的 “Dark-based optical sectioning assists background removal in fluorescence microscopy” 一文,提出了一种创新的 Dark sectioning 方法,为解决这一难题带来了新的希望。
该研究致力于打破荧光显微镜中散焦背景与低时间分辨率、复杂设置之间的权衡,使生物发现中的亚细胞特征可视化更加清晰。

但是,在实际成像过程中,散射或离焦荧光产生的散焦背景会严重影响图像的清晰度,使得细胞细节难以分辨,甚至可能引入错误的信息,这极大地限制了荧光显微镜在生物学研究中的应用。
为了克服散焦背景的问题,现代光学显微镜技术不断发展,涌现出了激光扫描共聚焦显微镜、多光子显微镜、光学切片结构照明显微镜等先进的光学切片技术。
这些技术在一定程度上提高了成像质量,能够减少散焦背景的影响。
然而,它们也存在一些局限性,比如与传统的宽场显微镜相比,时间分辨率降低,光子效率下降,而且在深层组织成像时,散焦背景仍然会对图像质量产生较大的影响。
计算方法在光学显微镜的改进中发挥着越来越重要的作用。典型的计算荧光方法包括重建算法和预处理 / 后处理算法。
但是,大多数这些方法在处理图像时都需要先去除背景,以避免在最终图像中产生伪影。
传统的背景去除方法,如滚动球算法和滑动抛物面算法,主要基于散焦信息位于低频的假设,这种假设往往会导致散焦背景去除不彻底或不正确,同时还会损失图像中的微弱信号。
而先进的开源背景去除算法和商业算法,虽然在某些特定的成像模式下有一定的效果,但适用范围有限,获取难度较大,无法满足广泛的成像研究需求。
暗通道先验在自然户外图像去雾方面取得了显著的成功,它能够有效地去除图像中的雾霭,提高图像的清晰度。
但是,荧光图像的结构复杂,背景分布不均匀,像素灰度代表荧光发射强度,这使得暗通道先验难以直接应用于荧光图像的背景去除。
在这样的背景下,研究团队开发了 Dark sectioning 方法,旨在解决荧光显微镜中的散焦背景问题,提高图像质量,为生物学研究提供更有力的工具。
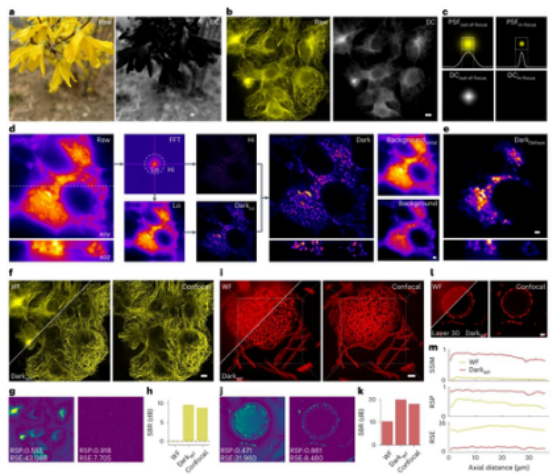
暗通道先验最初是用于自然图像去雾的方法,其核心概念是在无雾的户外图像中,大多数局部块在至少一个 RGB 通道中都包含一些强度非常低的像素,图像的暗通道可以表示为局部块内 RGB 通道的最小值。研究团队发现,当聚焦物体颜色单一时,暗通道能够区分聚焦和离焦信息。
例如,在图 1a 中,聚焦的黄色花朵的暗通道几乎为零,而离焦的叶子的暗通道则呈现出块状的非零波动值。
当对宽场图像进行暗通道操作时,研究人员发现离焦部分的暗通道几乎与背景分布相同(图 1b)。
这是因为离焦背景可以表示为真实图像与离焦点扩散函数的卷积,由于物理特性,离焦点扩散函数大于聚焦点扩散函数,所以聚焦点扩散函数的暗通道呈现全零值,而离焦点扩散函数的暗通道呈现非零值(图 1c)。
基于此,研究团队将此定义作为区分荧光图像中聚焦和离焦信息的核心,即 Dark sectioning 的原理,并重新定义了暗通道中的块大小,使其略大于聚焦点扩散函数,以更好地区分聚焦和离焦信息。
由于背景主要存在于图像的低频部分,研究团队将图像分为低频部分和高频部分,仅对低频部分进行 Dark sectioning 处理,以保留微弱信息(图 1d)。
然后,将低频部分进一步分为初始背景部分和无背景部分,并通过一定的传输比率进行分离。
此外,在去雾算法中引入不均匀背景,而不是固定的大气,以更好地拟合荧光图像的背景分布,通过调整参数量化全局离焦信息,并对局部和全局背景进行迭代去除。最终,得到去除背景后的图像。
该显微镜包含宽场(WF)、HiLo、2D 结构照明显微镜(2DSIM)和 3D 结构照明显微镜(3DSIM)等多种模式。
通过该显微镜,可以对不同成像模式下的图像进行对比分析,评估 Dark sectioning 对不同成像模式的优化效果。
例如,用 PKmito RED 标记 COS-7 细胞的线粒体,用 SiR Tubulin kit 标记微管蛋白等。在动物实验方面,使用了 C57BL/6 小鼠和转基因小鼠,对小鼠的肾脏、大脑等组织进行切片处理,并进行相应的标记,用于观察不同组织中的细胞结构和背景去除效果。
将 Dark sectioning 与传统的背景去除方法,如滚动球算法、滑动抛物面算法、稀疏反卷积的背景去除部分等进行对比,评估不同方法在去除背景方面的效果。
同时,还将 Dark sectioning 与其他先进的成像技术和算法,如共聚焦显微镜、3DSIM、HiFi-SIM 等进行对比,分析 Dark sectioning 对图像质量提升的独特优势。
以小鼠尾切片的宽场图像为例,展示了 Dark sectioning 的简化算法流程,包括高频和低频部分的分离、低频部分的处理以及最终结果,同时给出了相应的暗通道图像、误差图和信噪比(图 1d)。
通过与传统的基于暗通道先验的去雾方法对比,发现传统方法在处理小鼠尾切片图像时,会丢失微弱信息且背景去除不正确,而 Dark sectioning 能够更详细地去除背景,保留样本的精细信息(图 1e)。
对于 3D 图像,研究团队将 3D 堆栈中的每一层图像作为 2D 图像进行处理,由于其背景去除的稳健性,xoz 平面显示出很好的连续性,能够进一步消除 2D 结构照明显微镜重建时的不连续性(图 1d)。
研究团队还对薄微管蛋白样本的宽场、共聚焦以及经 Dark sectioning 处理后的宽场图像进行了对比(图 1f),使用 Nanoj 插件评估图像的保真度,发现 Dark sectioning 能够将分辨率缩放的皮尔逊系数(RSP)从 0.55 提高到 0.918,将分辨率缩放的误差(RSE)从 43.088 降低到 7.705,同时将宽场图像的信噪比(SBR)从约 - 1dB 提高到 9dB(图 1g、1h)。
对于 3D 曲霉分生孢子样本的测试也表明,Dark sectioning 能够稳定地将结构相似性指数(SSIM)提高约 10 倍,最大结构相似性指数超过 0.9,分辨率缩放的皮尔逊系数提高两倍,分辨率缩放的误差降低四倍(图 1i - 1m)。
此外,研究团队还评估了 Dark sectioning 在不同信噪比条件下的性能,结果表明,即使在极低信噪比和不均匀样本的情况下,Dark sectioning 依然有效。
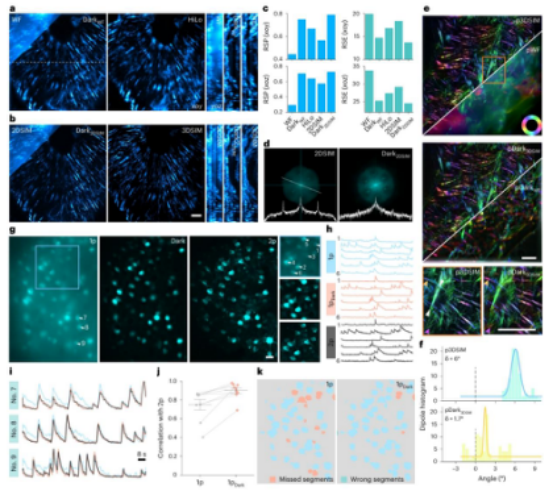
以小鼠肾脏切片为例,对比了宽场、Dark sectioning 处理后的宽场、HiLo、2D 结构照明显微镜、3D 结构照明显微镜以及 Dark sectioning 处理后的 2D 结构照明显微镜图像(图 2a、2b)。
结果发现,Dark sectioning 能够正确去除宽场和 2D 结构照明显微镜的散焦背景,并且在以 3D 结构照明显微镜图像为基准进行评估时,Dark sectioning 处理后的图像在 xoy 和 xoz 平面上的分辨率缩放的皮尔逊系数和分辨率缩放的误差都优于宽场、2D 结构照明显微镜甚至 HiLo 图像(图 2c)。
从 2D 结构照明显微镜和 Dark sectioning 处理后的 2D 结构照明显微镜的傅里叶域可以看出,Dark sectioning 能够极大地抑制散焦背景引起的频率峰值(图 2d)。
肌动蛋白丝的偶极取向可以验证 Dark sectioning 的背景去除保真度。
研究团队对比了极化宽场、极化 3D 结构照明显微镜、Dark sectioning 辅助的极化宽场以及 Dark sectioning 辅助的极化 3D 结构照明显微镜下肌动蛋白丝的图像(图 2e)。
由于散焦背景会改变宽场图像的强度比,从而影响偶极取向的分析,而 Dark sectioning 能够极大地保留极化信息,将 3D 结构照明显微镜中的极化精度从 6° 提高到 1.7°(图 2f)。
研究团队还使用定制的单光子和双光子联合成像系统,验证了 Dark sectioning 在小鼠脑组织中去除背景和提高神经元提取准确性的能力。
以双光子图像为基准,对单光子图像进行 Dark sectioning 处理后,发现 Dark sectioning 能够在空间和时间维度上恢复被背景淹没的神经元的聚焦信息(图 2g - 2i)。
通过计算单光子图像在 Dark sectioning 处理前后与双光子图像的时间皮尔逊相关系数,发现相关系数从 0.749 ± 0.052 提高到 0.898 ± 0.023,这进一步说明了 Dark sectioning 的高保真度(图 2j)。
最后,对单光子和 Dark sectioning 处理后的单光子图像进行神经元分割,发现 Dark sectioning 能够区分出更多被散焦背景遮挡的神经元(图 2k)。
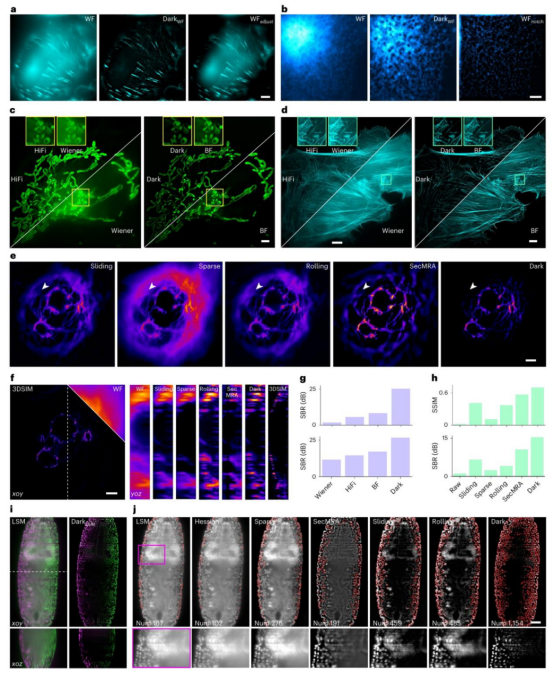
对比 Dark sectioning 和宽场图像在对比度调整后的效果,发现当背景较强时,调整对比度不仅无法有效去除背景,还可能掩盖小鼠肾脏中肌动蛋白丝的微弱信息(图 3a)。
对比 Dark sectioning 和使用低频陷波滤波器处理后的宽场图像,发现陷波滤波器会丢失内质网小管的全局信息,使其变得不连续和碎片化(图 3b)。
在对不同 SIM 重建算法的背景抑制能力进行对比时,发现 Dark sectioning 能够大大减少散焦背景引起的点状伪影。
Wiener - SIM、HiFi - SIM、BF - SIM 和基于 Dark sectioning 的 SIM 在背景抑制能力上逐渐增强,伪影逐渐减少(图 3c、3d)。
在对 COS - 7 细胞中微管蛋白的背景去除实验中,只有 Dark sectioning 能够消除微管蛋白外侧的背景,且与 3DSIM 图像的相似度最高(图 3e、3f)。
通过量化不同 SIM 算法的信噪比和结构相似性指数,发现 Dark sectioning 的信噪比接近 25dB,优于 BF - SIM、HiFi - SIM 和 Wiener - SIM,其结构相似性指数也更高(图 3g、3h)。
研究团队还对不同厚度和复杂度的样本进行了实验,包括约 3μm 的肌动蛋白丝、约 40μm 的向日葵茎切片和约 200μm 的小鼠神经元。
结果表明,在处理这些样本时,Dark sectioning 能够成功去除其他方法难以去除的局部背景,在分辨率缩放的皮尔逊系数、结构相似性指数和分辨率缩放的误差等指标上表现最佳。
与 Leica 的商业软件 ICC 相比,Dark sectioning 在保留微弱信息和去除局部背景方面更具优势。
在对果蝇胚胎数据的处理中,Dark sectioning 能够大大减少深层组织中因质量下降引起的背景,从而避免细胞核的误分类,并且能够显著增加可识别的细胞核数量,提高显微镜图像的定量评估能力(图 3i、3j)。
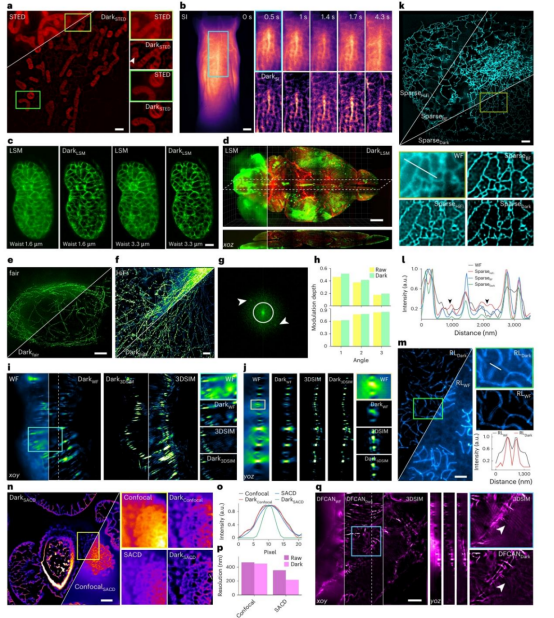
研究团队应用 Dark sectioning 处理 550μm 和 650μm 深度的小鼠脑 2p 图像并进行神经元分割,发现 Dark sectioning 能够识别出更多被背景遮挡的神经元(图 4a)。
对于新提出的 2pSAM 显微镜,Dark sectioning 同样能够帮助其识别更多神经元(图 4b)。
通过对比 2p、Dark sectioning 处理后的 2p、2pSAM 和 Dark sectioning 处理后的 2pSAM 的信噪比和神经元数量,发现 Dark sectioning 能够稳定提高信噪比和识别准确率(图 4c、4d)。
此外,Dark sectioning 能够避免细胞核的过度分割,几乎每个分割区域都能准确对应实际的细胞核或神经元,这表明该技术能够有效保留微弱信号。
在对曲霉分生孢子进行光场显微镜成像和分割时,Dark sectioning 不仅能够消除散焦信息,还能大大提高复杂线形分割的准确性(图 4e、4f)。
在对前列腺病理切片的研究中,传统的苏木精 - 伊红(H&E)染色只能提供约 5μm 内的 2D 图像,而该研究使用 3D 荧光成像,能够更全面地反映前列腺切片的空间分布,但散焦背景严重影响了细胞核的可视化和识别。
通过应用 Dark sectioning,能够更清晰地观察细胞核,并且在分割细胞核时,Dark sectioning 能够分割出约 600 个细胞核,而其他方法只能分割出不到 200 个(图 4g - 4i)。
通过对前列腺样本的淋巴和腺区域的荧光图像进行虚拟染色得到 H&E 染色图像,发现 Dark sectioning 能够使包含大量背景的深层 3D 荧光图像更接近传统的 2D H&E 染色厚图像,有望与深度学习分割和分类技术结合,帮助病理学家更好地判断样本信息。
在受激发射损耗显微镜(STED)中,Dark sectioning 能够帮助去除背景,使线粒体嵴更清晰(图 5a)。
在对活小鼠血管进行小动物成像时,Dark sectioning 处理后的图像能够有效去除小鼠皮肤或其他组织引起的散射背景,更好地显示小鼠血管的位置和变化(图 5b)。
通过对不同束腰的开源数据进行交叉验证,发现 Dark sectioning 能够使束腰为 3.3μm 的光片数据的光学切片能力超过束腰为 1.6μm 的数据(图 5c)。
Dark sectioning 还能够处理小鼠全脑的大视野数据,使原本模糊的小鼠血管组织变得清晰可见(图 5d)。
在处理 3DSIM 图像时,以小鼠肾脏切片中的肌动蛋白丝为例,对比 WF、Dark sectioning 处理后的 WF、3DSIM 和 Dark sectioning 处理后的 3DSIM 图像(图 5i),可以发现 Dark sectioning 不仅能够正确区分和去除 WF 图像的散焦背景(这一点由 3DSIM 验证),还能大大减少 3DSIM 图像在轴向平面上由散射背景引起的伪影(图 5j)。
在对表达 mCherry - Cytb5ER 标记的内质网小管进行成像时,Dark sectioning 能够帮助稀疏反卷积消除相邻小管之间背景引起的伪影(图 5k)。
基于 Dark sectioning 的稀疏反卷积(SparseDark)在减少伪影方面表现优于基于 HiFi - SIM 和 BF - SIM 的稀疏反卷积(图 5l)。
在处理小鼠精母细胞中的联会复合体时,Dark sectioning 能够帮助 Richardson - Lucy(RL)反卷积获得更好的分辨率(图 5m)。
在应用超分辨率光学涨落成像(SOFI)技术时,使用基于自相关的两步反卷积(SACD)算法,Dark sectioning 虽然不能大幅提高基于共聚焦显微镜的分辨率,但能够增强聚焦信息,为 SACD 提供更多信息。在对松树幼嫩雄花序切片成像时,使用 rFRC 评估分辨率,发现 Dark sectioning 使 SACD 的分辨率从 353.314nm 提高到 216.784nm,且重建误差更小(图 5n - 5p)。
1.细胞样本:选取合适的细胞系,如常见的 COS-7 细胞、U2-OS 细胞等。
例如,若研究线粒体相关功能,可用 PKmito RED 对 COS-7 细胞的线粒体进行标记;若关注微管蛋白,则可使用 SiR Tubulin kit 进行标记。将标记好的细胞接种于合适的培养皿或玻片上,确保细胞状态良好且分布均匀,以便后续成像观察。
2. 组织样本:对于动物实验,以小鼠为例,可选用 C57BL/6 小鼠或转基因小鼠。获取小鼠的目标组织,如肾脏、大脑等,迅速进行冰冻切片或石蜡切片处理。切片厚度需根据具体实验需求和组织类型确定,一般在数微米至数十微米之间。切片完成后,进行相应的荧光标记,如用特定抗体标记肾脏组织中的特定蛋白,以突出目标结构。
成像设备与参数设置
1.选择显微镜:Dark sectioning 可兼容多种显微镜技术,如宽场显微镜、极化显微镜、激光扫描 / 转盘共聚焦显微镜、受激发射损耗显微镜、光片显微镜和光场显微镜等。根据实验目的和样本特性选择合适的显微镜。
例如,若需要对活细胞进行实时动态观察,宽场显微镜结合高速相机可能是较好的选择;若要获取高分辨率的三维图像,光片显微镜或 3D 结构照明显微镜更为适宜。
2. 参数优化:针对所选显微镜,对成像参数进行优化。包括但不限于调整激发光强度、曝光时间、增益等。
以宽场显微镜为例,激发光强度不宜过高,以免造成荧光淬灭;曝光时间需根据样本荧光强度进行调整,确保既能获取足够的信号,又不会过度曝光导致图像饱和。
对于不同的荧光标记物,还需选择合适的激发和发射滤光片,以保证特异性的荧光信号采集。
确保采集到的图像清晰、完整,包含足够的细节信息。
对于三维成像,需采集一系列不同层面的二维图像,构建三维图像堆栈。例如,在对小鼠肾脏切片进行成像时,从切片的一侧开始,以一定的步长(如 0.5μm)逐层采集图像,直至覆盖整个切片厚度。
该软件需具备与常见显微镜图像格式(如 TIFF、ND2 等)兼容的能力,以确保图像能够顺利导入。
2. 图像格式转换与预处理(若有必要):部分情况下,可能需要对图像进行格式转换或简单的预处理,如调整图像的亮度和对比度,使其在后续处理中更易于分析。
但需注意,预处理操作应尽量温和,避免丢失重要的图像信息。
其中,块大小的设置至关重要,需根据样本的特性和成像分辨率进行调整。
一般来说,块大小应略大于聚焦点扩散函数,以更好地区分聚焦和离焦信息。
例如,对于分辨率较高的图像,块大小可设置为较小的值(如 5×5 像素);对于分辨率较低或样本结构较大的图像,块大小可适当增大(如 10×10 像素)。
传输比率参数则影响背景去除的程度,通常需要通过多次试验,结合图像的实际效果进行优化,一般取值范围在 0.1 至 0.9 之间。
2. 运行算法:设置好参数后,点击运行按钮,Dark sectioning 算法将对输入的图像进行处理。
算法首先将图像分离为高频和低频部分,仅对低频部分进行后续操作,以保留微弱信号。
接着,在低频部分中进一步区分初始背景部分和无背景部分,并通过迭代计算,逐步去除散焦背景。
整个处理过程的时间取决于图像的大小和计算机的性能,一般对于普通的二维图像,处理时间在数秒至数十秒之间;对于大型的三维图像堆栈,处理时间可能会延长至数分钟。
通过可视化工具,仔细观察图像的细节,评估背景去除的效果。
对比处理前后的图像,查看是否有效消除了散焦背景,同时保留了样本的关键结构和特征。
例如,在观察小鼠肾脏切片图像时,应能清晰看到肾小管、肾小球等结构,且背景干净,无明显的模糊或杂散光干扰。
2. 定量评估:利用相关的图像分析软件,对处理前后的图像进行定量评估。
可采用的指标包括信噪比(SBR)、结构相似性指数(SSIM)、分辨率缩放的皮尔逊系数(RSP)和分辨率缩放的误差(RSE)等。
一般来说,经过 Dark sectioning 处理后,图像的 SBR 应显著提高,SSIM 应更接近 1,RSP 增大,RSE 减小。若评估结果不理想,可返回参数设置步骤,调整参数后重新运行算法,直至获得满意的结果。
免责声明:本文旨在传递更多科研资讯及分享,所有其他媒、网来源均注明出处,如涉及版权问题,请作者第一时间联系我们,我们将协调进行处理,最终解释权归旭为光电所有。