显微“新贵”,看向更深:展望三光子显微成像技术
随着飞秒激光技术的不断进步,显微“新贵”三光子显微成像的潜力逐渐展现,其在深度成像、分辨率等方面展现出独特的优势,在活体深层组织成像中具有巨大潜力,有望推动生命科学研究和医学诊疗技术的进步。
自1990年双光子显微镜(TWo-photon microscopy, 2PM)被首次报道以来,基于飞秒激光的非线性效应,双光子显微镜相较于常规连续光激发的显微镜(如共聚焦显微镜),具有两个明显的优点:①双光子激发波长更长,一定程度上可减少对样品的光漂白和光损伤;②基于非线性效应带来了光学切片能力,使成像系统中无须共聚焦小孔。1
相较于可见光波段,近红外光在生物组织内的穿透性更高,衰减程度更小,使成像深度变得更深,使得大多数以近红外波长激发的双光子显微镜迅速成为脑科学结构及功能研究的重要工具。类比于其他光学成像技术,如光学相干断层成像(OCT)和光声成像(PAM/PACT)等,其他技术虽在成像深度上同样具备优势,但在分辨率上通常难以达到双光子显微镜亚微米级的细胞成像分辨率水平。
进一步地,康奈尔大学研究团队于2013年发现三光子显微镜(Three-photon microscppy, 3PM)相比于双光子能更大程度地利用飞秒激光,以更高的非线性系数进行更深层样本的激发与成像。自此,三光子显微成像技术逐渐走进大家的视野,彰显“威力”。

如图1所示,在双光子及三光子显微成像的示例中,随着深度的增加(> 550 μm),组织深处的三光子成像分辨率显著由于双光子显微镜。结合自适应光学技术可以进一步获得令人振奋的结果——三光子显微成像甚至可以直接透过小鼠颅骨进行神经元及血管成像,如图2所示。2-5
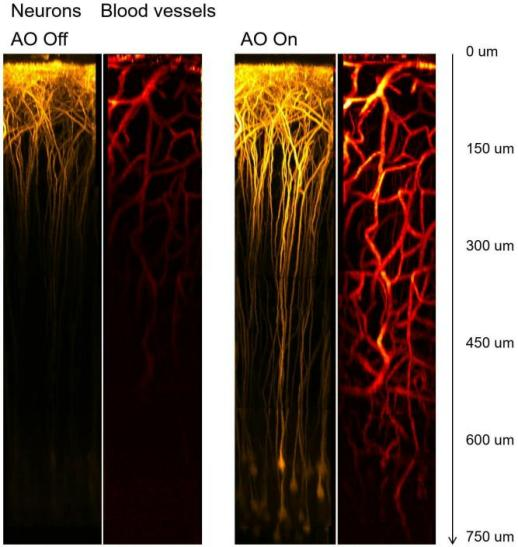
众所周知,成像深度受限于生物组织内光子的散射和吸收。就激发光而言,随着成像位置越深,到达焦面处的光子就越少。看似可通过增加激光功率来补偿光子的损失,然而生物样品表面光功率过强则可能会造成样品损伤的风险。即使控制激发光束功率低于组织损伤阈值,但随着焦面变深,激发光束也会在样品表面至焦面的“锥体”内产生不同程度的背景噪声。当到达某一深度时,背噪强度会彻底湮没信号,最终限制成像深度。在双光子成像中,目标成像深度一旦超出成像信背比(SBR)极限时,纵使增加激发光功率,也难以提升图像质量。而三光子成像因为具备更高的非线性条件,可有效降低背景,获得了比双光子成像更深的范围。
三光子显微成像看似具有如此显著的优势,但是实际应用过程中似乎仍面临不少技术问题。美国Allen脑研究所的学者表示:“三光子成像技术的现状,类似于早期双光子诞生时类似的情况——即在成像新技术刚问世的数年内,人们在实际成像时仍需要花费大量精力来获取高质量、有意义的图像。”那么,相比于较为成熟的双光子成像技术,目前三光子成像技术发展还存在哪些难点,又该如何克服?
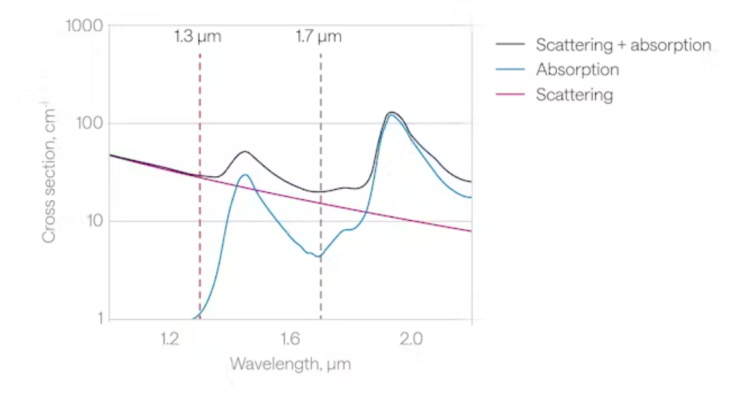
与双光子过程相比,三光子激发需要具备更长的入射波长。例如,常用的神经示踪剂GCaMPs绿色荧光蛋白,其双光子激发波段为920~940 nm,但在三光子激发时波长则需要拓展至~1300 nm。又比如,红移探针需要~1100 nm双光子激发波长,而三光子中则需要在~1700 nm处激发。4,5因此可见,波长可调谐的激光器,相比于单一波长的激光器,能满足不同的荧光分子的激发波长调谐需求,在双光子、三光子成像研究中占据主流。实际应用中,就波长而言,针对各类稳定调谐激光器、成像窗口、成像探针等问题,仍有较大发掘空间。
双光子成像所使用的飞秒激光器产生的脉宽大多为100~150 fs。而三光子过程所依赖的更高非线性,在很大程度上取决于脉冲的峰值功率,所以三光子成像则需要更短的脉宽(~50 fs)。但是在大多数情况下,如何产生稳定且更短的(~50 fs)飞秒脉冲光仍是三光子技术的挑战之一。此外,因为超短脉冲光束在材料中传播时,会出现群延迟色散(Group delay dispersion, GDD),导致不同的光谱成分在时间上被拉伸开来,在时域上体现为脉宽变宽,使脉冲峰值功率降低,进而造成多光子信号强度降低、图像信噪比降低。
为了解决上述色散问题,在焦面处产生最佳的非线性信号,人们往往在光学系统中加入脉冲压缩元件,对群延迟色散进行预补偿(预啁啾)。但是,脉宽越短意味着光谱带宽越大,这使得脉宽压缩元件的设计与制造工作具有相当大的挑战性。因此在多光子成像技术发展历程中,不少杰出的成像研究者们都曾聚焦于解决飞秒脉冲管理,构建合适的脉宽压缩组件,使得脉冲在焦平面上的脉宽最短。
脉宽压缩程度至关重要。当脉宽压缩充足时,保障了三光子信号采集的必要条件;倘若压缩不充分、脉宽过大,则纵使将功率调高到烧坏样品的水平,也根本无法探测到三光子信号。由此见得,针对三光子成像,激光器本身的研究其实仍然大有可为、充满挑战。
从实现双光子到实现三光子,由于两者的激发截面的差异,三光子的实现不仅需要将脉冲缩短到~50 fs左右,还需要大幅增加单脉冲能量。但是市售显微物镜及其他光学元件,几乎较少针对三光子激发波长进行高透射、低色散设计及优化,很可能使得全系统的透过率仅为10%左右。因此,应当充分考虑如何权衡好峰值功率(脉冲能量)、重复频率、平均功率这三个主要参数之间的关系。
大多数情况下,飞秒激光~100 mW左右的平均功率,可在点扫描时确保生物样品无损伤。而针对上述估算的10%光学系统透过率而言,所采用的三光子成像飞秒激光器则应产生至少~1 W的平均功率。随之会带来有趣的问题:1W的平均功率,究竟是以“1 MHz,1 μJ”形式输出,还是通过“10 MHz,100 nJ”输出?目前,大多数三光子成像都是在1 MHz重频下进行,像素驻留时间为数微秒,每个像素累积单个或多个脉冲产生的信号,所以可以在每秒数帧的成像的帧率下产生足够的信号量。若通过提高重频以匹配共振镜谐振频率,确实可以进一步加速成像帧率,但随之带来的是平均功率的增加,可能会增大样品损伤风险。
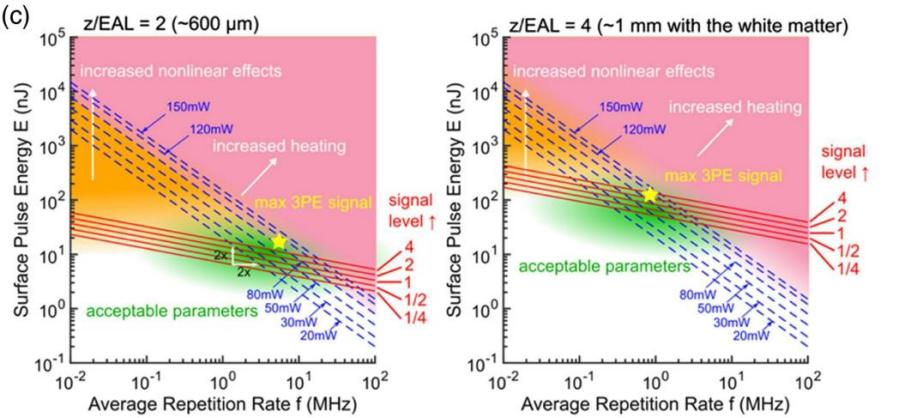
一味地把单脉冲能量拉高时,理想情况下会产生越来越明亮的多光子信号,但实际情况是:能量过高会导致组织非线性损伤。同理,虽然增大平均功率、重复频率,可以增强信号并实现高速成像,但功率过大也会导致热效应过高。这些因素使得激光器波长范围内的三光子成像窗口并不宽裕,而且成像窗口会随样品和成像深度产生变化,使三光子成像激光器的参数选择变得复杂。已有研究讨论了最佳重复频率与组织散射、成像深度的函数关系,如图4所示。从图中绿色区域可以看出,入射光最佳参数范围随着深度的增加而明显变化。例如,在600 μm深度处,重频越高越好;而在1 mm深度处,则存在1 MHz的最优重频。6
相比于传统双光子成像飞秒激光器80 MHz的高重频,三光子成像时,需要激光器具有较低重复率、较高的单脉冲能量,因此往往利用1030 nm高能量激光来泵浦可调谐光学参量放大器(OPA),从而调谐至相对合适的激发波长。大多数OPA的波长、重频、功率虽然可调,但通常只能以恒定不变的泵浦能量运转,因此成像时一般需确保组织深处足够的能量裕量,而对较浅平面成像时则需进行温和地能量控制。
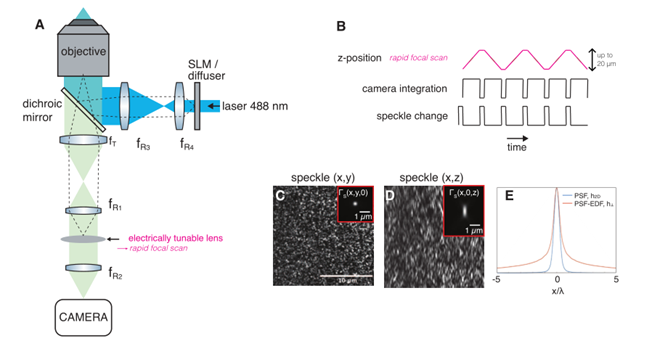
由此可见,激光器能量、功率、光束模式以及长期稳定性,也属于三光子成像技术的考量范畴。特别是在用于快速三光子成像时,由于单像素驻留时间短,激光噪声抖动对于图像质量影响突出。7而在数智光学时代,在增强多光子成像深度和对比度方面,迅猛发展的自适应光学技术也充满着巨大潜力及研究价值。8
回顾过去,随着可调谐激光器向着“小型化、易使用”的方向发展,已成功促进了双光子显微成像技术的发展与应用。与之类似,三光子成像激光器可能也将出现类似的发展趋势,如:激光源将变得更加可靠、结构更紧凑、操作更简便、参数调节更灵活。
未来,三光子显微成像的发展离不开新型可调谐光源、成像策略方面的深入研究。令人兴奋的是,国内外诸多团队正取得可喜进展,例如麻省理工学院团队通过光纤的受控弯曲,9直接通过自相位调制来修饰脉冲频谱。又例如康奈尔大学团队开发自适应激发源(AES),10,11激光器不拘泥于固定的重频运行,而是借助样品及激光器之间复杂精细的闭环反馈,在扫描至神经元上方时才精确产生脉冲,使得既能保证平均功率安全可控、又能实现更高更快的瞬时重复频率。这些技术新进展虽然仍部分处于原理验证阶段,但随着多学科研究者、工程师的共同努力,很有可能在未来的神经成像实验室中,见到三光子显微成像技术范式的广泛应用。
近年来,我国科研团队在生物医学多光子显微成像领域的技术进展不断,例如中国激光杂志社Photonics Research 今年第3期报道的北京大学程和平院士/王爱民教授团队的双物镜双光子成像(点击查看文章)、12第6期报道的清华大学孔令杰教授团队的双区域双光子成像(点击查看文章),13均展现了多光子显微成像技术正面向三维、深层、高分辨、多区域的神经科学观测需求稳步推进。
近年来,我国光电信息领域也积极开展先进成像技术创新及应用研究,逐步将新颖的成像方法应用于生物、天文、遥感等重要场景。诸多科技期刊也聚焦我国成像领域前沿进展,例如Advanced Imaging(AI),该双月刊由中国激光杂志社与西安电子科技大学杭州研究院联合出版。该刊由中国科学院西安光学精密机械研究所邵晓鹏教授与法国索邦大学Sylvain Gigan教授担任共主编,致力于发表成像及相关领域内的高水平基础和应用研究进展,推动先进成像技术的快速发展,增强该领域国内外的学术交流合作,促进科研成果的转化。欢迎大家投稿!
参考文献:
向上滑动阅览
1. W. Denk, J. H. Strickler, and W. W. Webb,Science, 248, 4951 (1990); https://doi.org/10.1126/science.2321027.
2. P. Theer, M. T. Hasan, and W. Denk,Opt. Lett., 28, 12 (2003); https://doi.org/10.1364/ol.28.001022.
3. N. G. Horton et al.,Nat. Photonics, 7 (2013); https://doi.org/10.1038/nphoton.2012.336.
4. G.-J. Bakker et al.,eLife, 11, e63776 (2022); doi:10.7554/elife.63776.
5. D. Tokarz et al.,PLoS ONE, 12, 10 (2017); doi:10.1371/journal.pone.0186846.
6. T. Wang and C. Xu,Optica, 7, 8 (2020); https://doi.org/10.1364/optica.395825.
7. L. Kontenis et al.,Proc. SPIE, PC12384, PC1238410 (2023); https://doi.org/10.1117/12.2649932.
8. C. Rodríguez et al.,Nat. Methods, 18, 10 (2021); doi:10.1038/s41592-021-01279-0
9. T. Qiu et al.,Nat Commun., 15, 1 (2024); doi:10.1038/s41467-024-46244-5.
10. S. Weisenburger et al.,Cell, 177, 4 (2019); doi:10.1016/j.cell.2019.03.011.
11. B. Li et al.,Nat. Methods, 2 (2019); doi:10.1038/s41592-019-0663-9.
12. M. Zhai et al., Photonics. Res. 3 (2024); doi: 10.1364/PRJ.516824
13.C. Liu et al., Photonics. Res. 6 (2024); doi: 10.1364/PRJ.504895
免责声明:本文旨在传递更多科研资讯及分享,所有其他媒、网来源均注明出处,如涉及版权问题,请作者第一时间联系我们,我们将协调进行处理,最终解释权归旭为光电所有。