刷新定量相位成像的空间带宽积
光学显微成像技术一直是生物医学与生命科学中的重要研究手段,也是单细胞分析的重要支撑技术之一。随着人类对生命现象本质研究的逐渐深入,新型光学显微技术层出不穷。然而由于细胞的弱吸收性,单细胞分析往往需要借助荧光成像。但现有的光学荧光显微成像方法存在两方面局限性:① 源于荧光标记:荧光染色复杂耗时,且荧光标记物不可避免地对细胞正常生理过程产生不利影响;荧光基团存在光漂白问题,影响对细胞的长时间观察;荧光标记往往只能突出部分生物分子而难以获得细胞整体全貌。② 源于光学显微成像系统:由于空间带宽积所限,提高分辨率与扩大视场往往是一对难以调和的矛盾,即无法同时满足“单细胞”与“高通量”的观测需求。
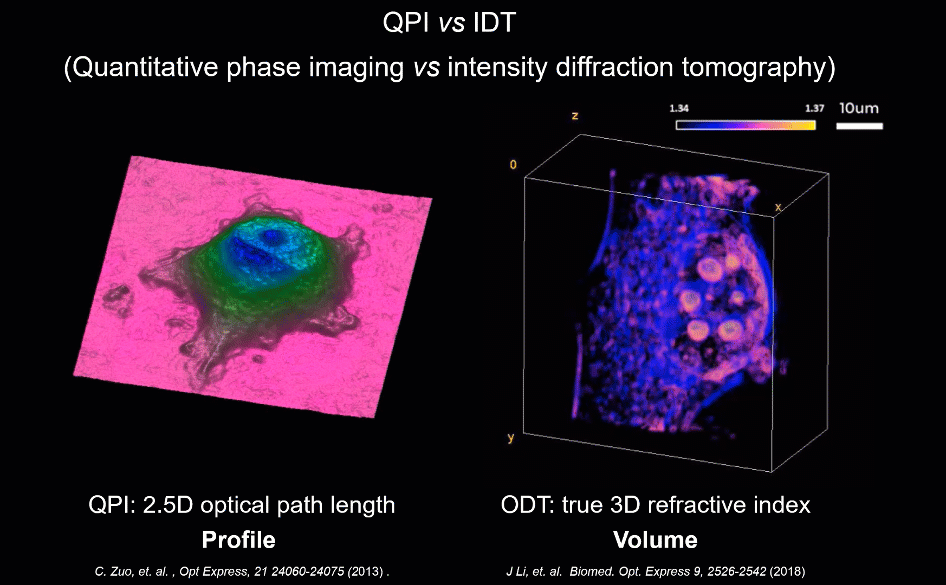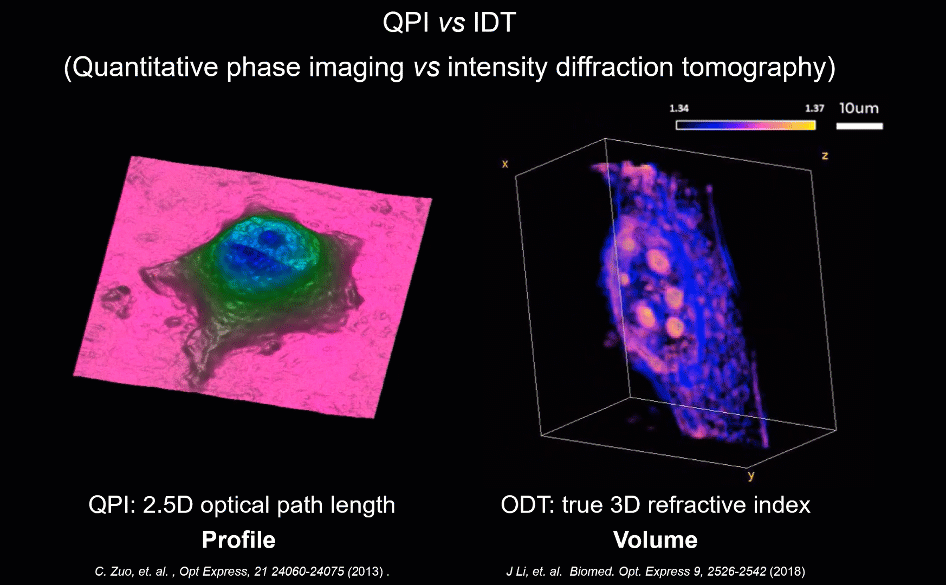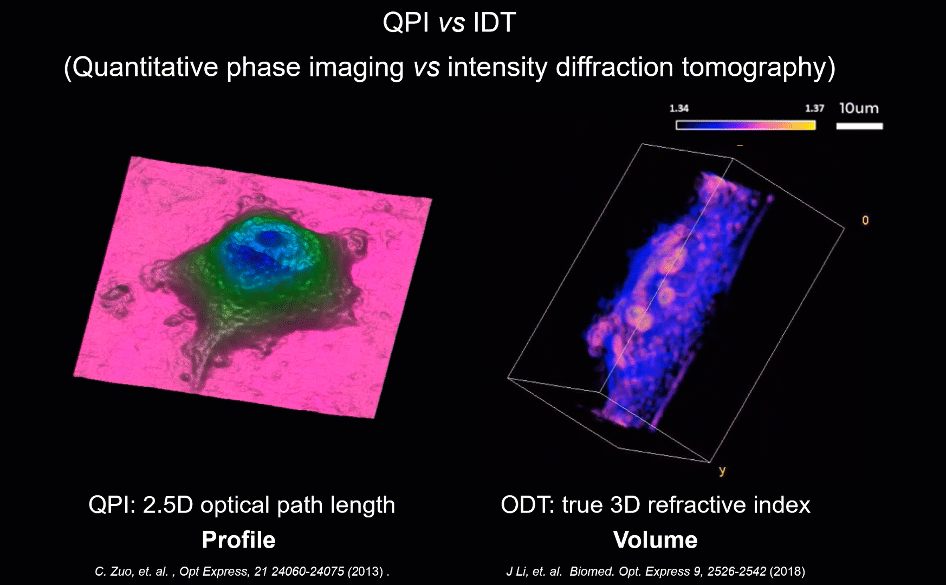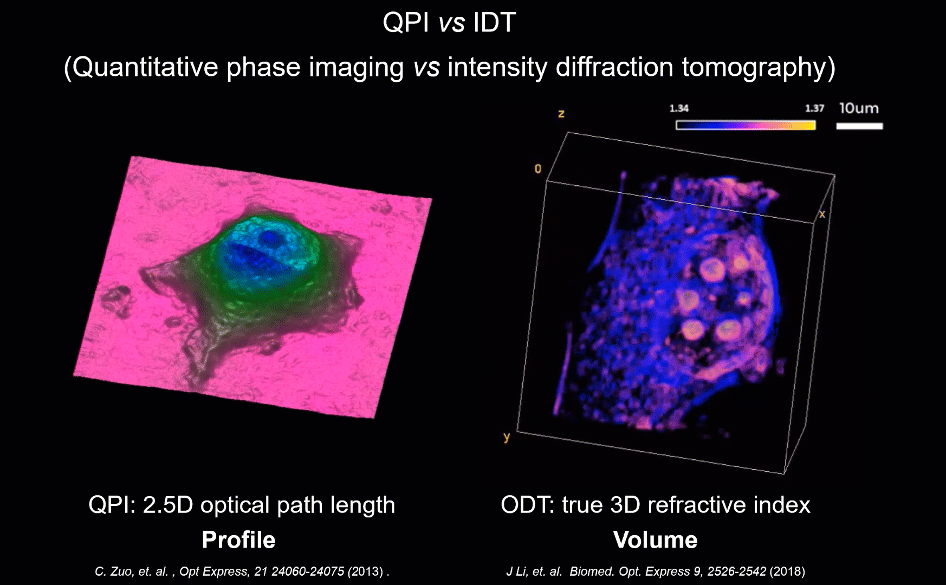
为解决上述因标记带来的成像难题,无标记(Label-free)显微技术为此提供了新的可能。当光通过几乎透明的物体(如细胞)时,其振幅几乎不变,而透射光的相位则包含关于样品的重要信息,如形貌与折射率分布。区别于荧光标记物这类外源性染料,相位可为高对比度成像提供合适的内源性染料。半个多世纪以来,新型无标记显微技术不断涌现,其中,“定量相位成像”技术由于其可以通过厚度及折射率系数等参数准确量化样品的信息,而被认为是“未来实现下一代无标记细胞成像的一项重大进展”。
研究人员基于照明复用与合成孔径理论,建立了非线性明暗场光强传输正向成像模型,赋予了HBDTI超越非相干衍射极限的细节成像能力。与仅使用明场照明的传统光强传输方程(TIE)相位恢复方法相比,HBDTI首次引入大角度暗场照明信息,仅需基于低倍率、低数值孔径(NA)物镜即可获得具有超越非相干衍射极限空间成像分辨率的高分辨、大视场的复振幅信息。
在对USAF分辨率板、血液涂片及未染色HeLa细胞的观测实验中,该技术的高通量成像能力得到了验证:HBDTI可在约7.19 mm2的宽视场下实现488 nm半宽分辨率的高分辨成像(4倍物镜,成像分辨率达到相干衍射极限的5倍以上),成像系统的空间带宽积提升了6.25倍。
- 装置示意与算法流程
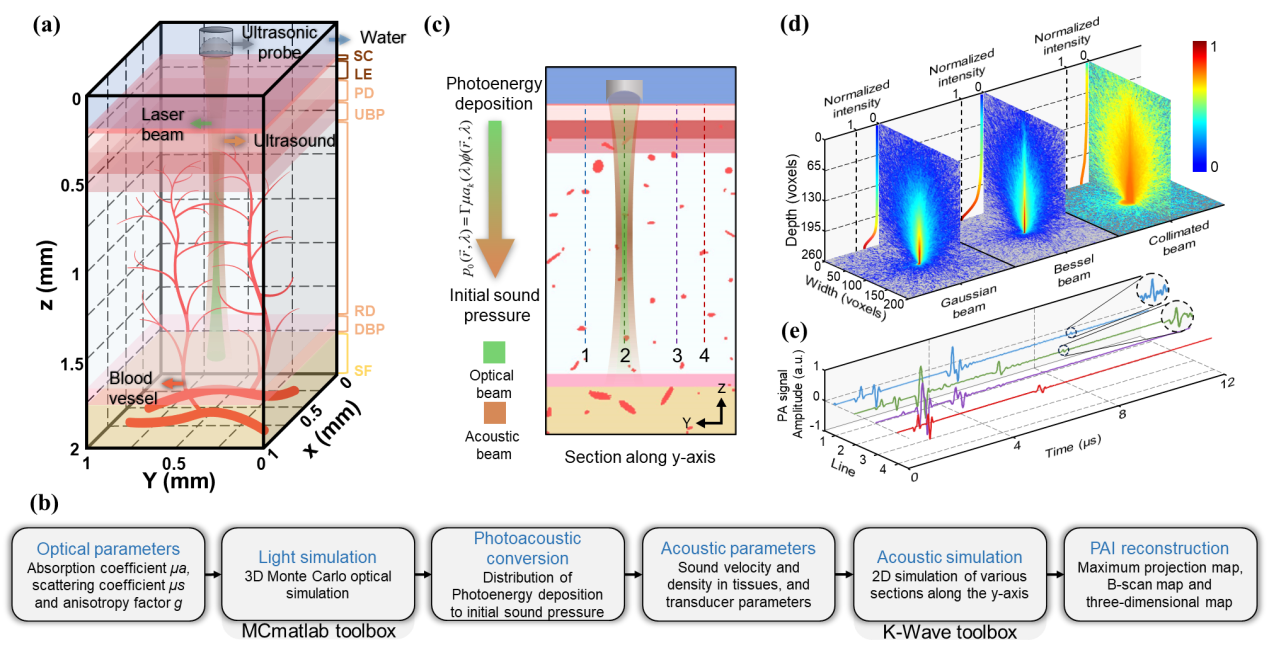
此研究所搭建的显微系统如图1所示,该系统为带有低NA、低倍率物镜的商用显微镜,并具备电动聚焦驱动器。对应光源被替换为可编程LED阵列,每个LED为三个单独通道以提供空间相干准单色照明,其由自主开发的电路驱动提供逻辑控制。
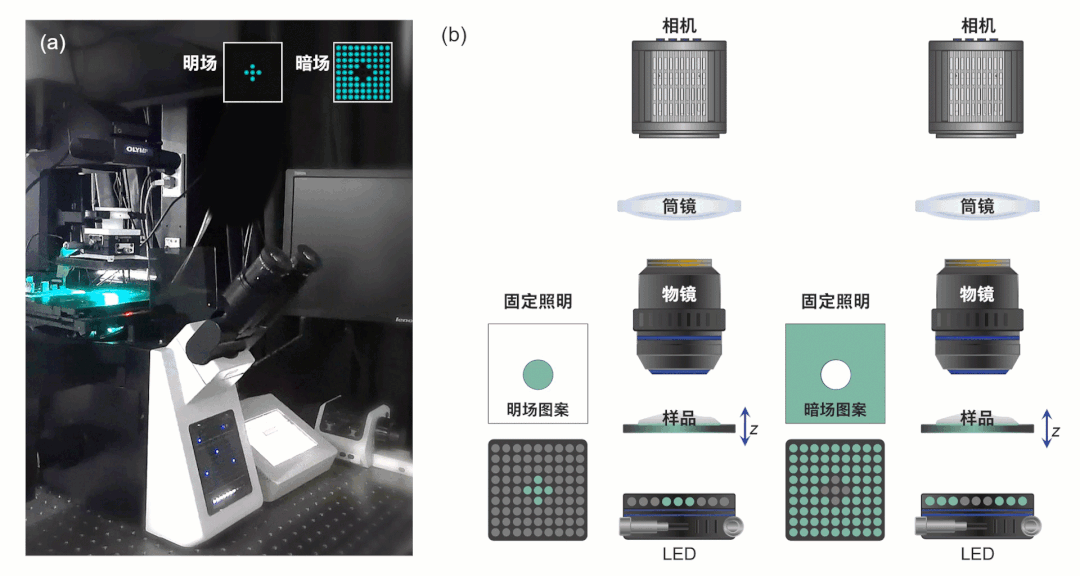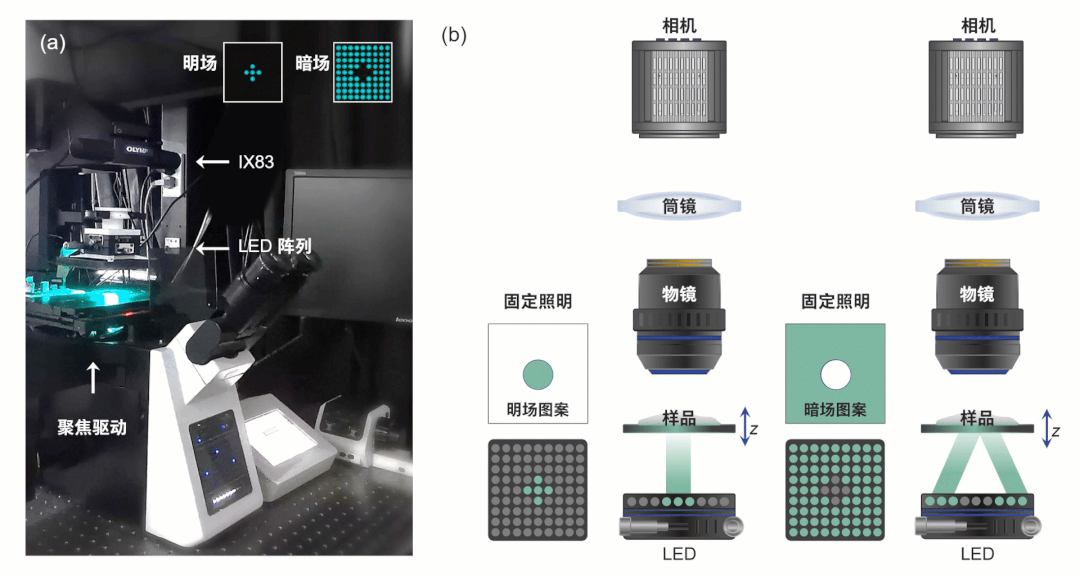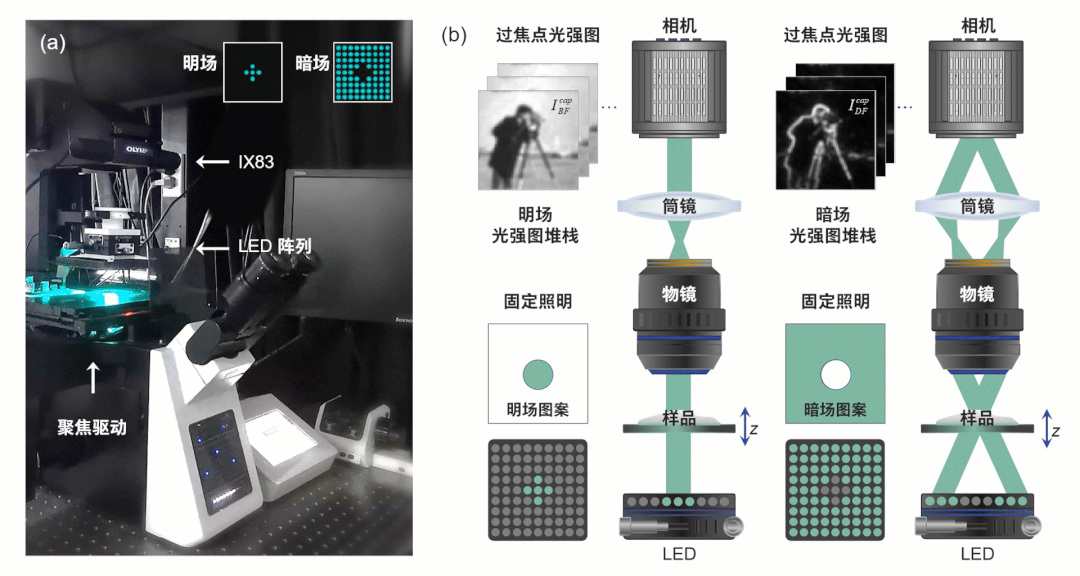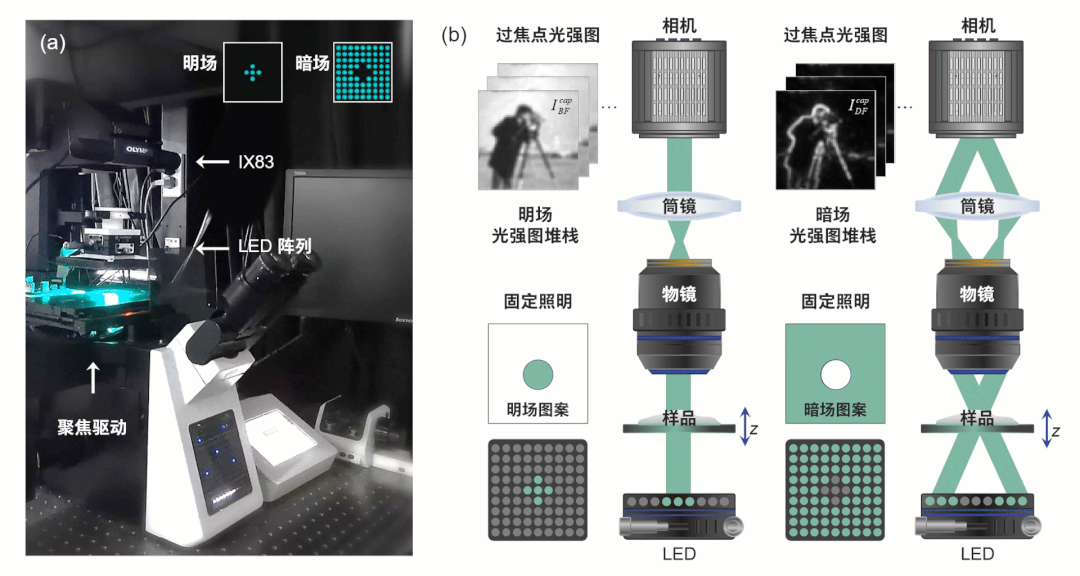
为获得超越非相干衍射极限的成像分辨率,突破传统TIE技术的局限性,HBDTI技术采用了如图2所示的技术路线。它以明、暗场照明下的两组轴向强度堆栈作为输入,基于照明复用与合成孔径理论,将相干模式分解与数值传播算法相结合,实现了对光强图成像模型的正向建模。而后,HBDTI采用了正向迭代约束更新的处理框架,绕过了复杂的求解非线性逆问题所伴随而来的系列难题,在保留低倍物镜大视场的同时可恢复出具有高分辨率的复振幅成像结果。

- 生物样品高通量重建
此外,为验证HBDTI对未染色生物样品的高通量成像能力,研究人员也对对未染色的HeLa细胞进行了观测对比(如图4所示)。基于HBDTI所重构的定量相位图像中可同时容纳约4000个HeLa细胞。较传统TIE技术而言,HBDTI的成像结果具有高衬度、高分辨等独特优势。
上述实验证明了HBDTI方法在细胞结构检测的高内涵分析、高通量原位观测方面所具备的潜力,并为从根本上系统揭示多细胞组织或集群中的生物组成和细胞异质性提供了可行的技术方案。


未来重点需要解决的问题包括减少所需数据采集量和提升成像速度等。研究人员希望进一步提升成像效率,以克服显微成像系统应对复杂生物样品(如细胞集群)快速单细胞研究的关键瓶颈,并探索其在活细胞生物学、免疫肿瘤学等领域中的新应用。从而以更高的时间分辨率在更深的层次上揭示生命过程中的化学本质与规律,为探究重大疾病的起因、发展、早期诊断与有效治疗提供更可靠的科学分析依据。
最后值得一提的是,该团队将“科研成果”与“手绘艺术”有机结合,论文第一作者卢林芃大胆且富有创意地创作了一段手绘视频来形象地阐述本文方法的核心思想,并得到了SPIE Newsroom的新闻推送,与多家媒体(phys.org、Newsachieve.com、AZO OPTICS等)的报道。

免责声明:本文旨在传递更多科研资讯及分享,所有其他媒、网来源均注明出处,如涉及版权问题,请作者第一时间联系我们,我们将协调进行处理,最终解释权归旭为光电所有。