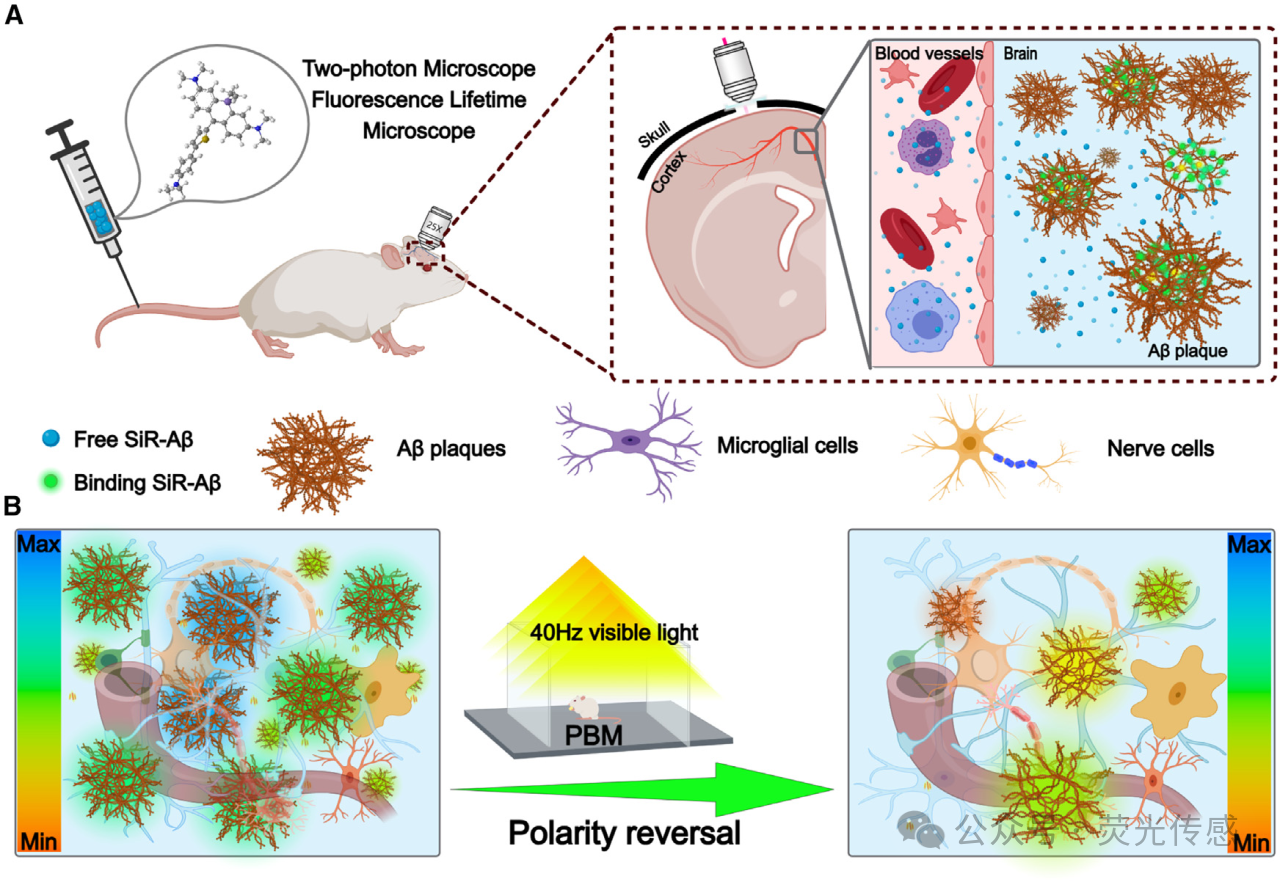
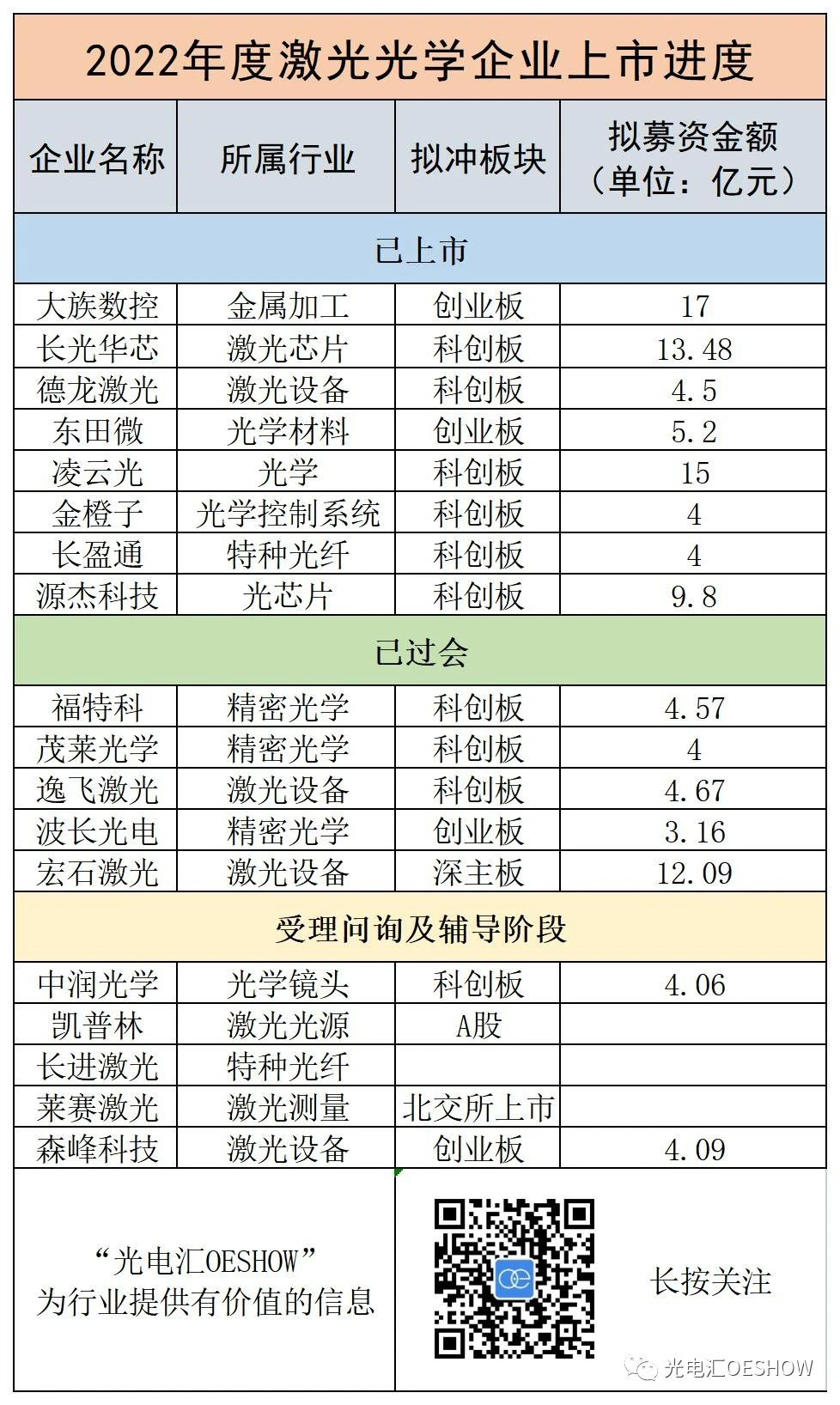
阿尔茨海默病(AD)是一种常见的神经退行性疾病,其特征是认知功能的逐渐下降。尽管AD的确切机制尚未完全清楚,但大量证据表明,β-淀粉样蛋白(Aβ)和神经原纤维缠结的异常聚集是该疾病的关键病理特征。因此,促进Aβ清除的策略已成为AD治疗开发的核心焦点。光生物调节(PBM)涉及将组织暴露于可见光或近红外(NIR)光(400-1100nm)下以产生非热生物效应,最近已成为改善脑功能的有前景的非侵入性方法。研究表明,PBM可能有助于缓解AD症状,尽管它增强AD的精确机制。Aβ清除仍然是一个正在调查的话题。拟议的途径包括诱导γ振荡、激活保护性免疫反应、上调神经保护基因和增强脑膜淋巴引流。然而,直接研究PBM对Aβ斑块物理化学性质的影响的研究仍然相对有限。研究PBM如何改变Aβ斑块内的微环境,可以发现Aβ清除机制的宝贵之处,并为开发更有效的AD治疗方法提供信息。
极性是化学生物学中的一个关键参数,影响蛋白质-蛋白质相互作用、膜脂质动力学和生物分子自组装等关键生化过程。细胞和蛋白质极性是由非共价相互作用的复杂平衡决定的,包括极化率、氢键以及亲水力和疏水力之间的相互作用。在AD中,Aβ斑块的形成是由蛋白质错误折叠和聚集驱动的,这一过程伴随着局部微环境极性的变化。因此,Aβ斑块极性已成为评估蛋白质错误折叠与聚集程度的有价值指标。在过去的十年中,已经开发了许多极性敏感的荧光探针来监测Aβ斑块,但实现这些斑块的准确、动态体内成像仍然是一个重大挑战。虽然基于强度的探针可用于研究Aβ聚集,但它们的可靠性往往受到激发光、探针浓度、背景噪声和光漂白变化的影响。相比之下,荧光寿命成像显微镜(FLIM)监测荧光团光子发射指数衰减的变化,为研究大分子结构和环境变化提供了一种更稳健的方法。FLIM不受光强度、探针浓度和光漂白等外部因素的影响,使其特别适合此类研究。当与极性响应探针结合时,FLIM在PBM治疗期间实时动态监测Aβ斑块极性方面具有巨大潜力。最近,已经开发了几种近红外荧光染料,如Cy3纤维蛋白、NIAD-4,和ZW800-1C,用于成像Aβ斑块和tau蛋白。这些染料在使用FLIM的AD模型中显示出有前景的应用。然而,大多数研究主要集中在体外模型或固定组织上,这限制了它们在体内成像中的潜在应用。
在这项研究中,作者开发了硅罗丹明Aβ(SiR-Aβ),这是一种极性敏感的荧光寿命探针,专门用于在PBM期间动态监测Aβ斑块内的极性变化,如图1所示。SiR-Aβ在体外和体内都得到了彻底的表征,显示出优异的血脑屏障(BBB)通透性和Aβ斑块的选择性靶向性。该探针对环境极性表现出非凡的敏感性,在低极性环境中其荧光寿命显著增加。使用FLIM,作者观察到随着Aβ斑块在体外生长,内部斑块极性逐渐降低,这一趋势在AD小鼠模型中也得到了证实。值得注意的是,当作者施加40 Hz的可见光刺激时,作者检测到斑块极性的逆转,与斑块大小无关,发生在Aβ斑块清除之前,如图1B所示。这些结果表明,Aβ斑块极性的变化可作为评估 PBM 疗效的重要生物标志物,并可为了解Aβ斑块的清除机制提供新的视角。
图1. SiR-Aβ对Aβ斑块的检测机制。(A)SiR-Aβ的静脉给药和脑穿透。SiR-Aβ化合物通过尾静脉注射全身给药于小鼠。(B) PBM后Aβ斑块的改变。SiR-Aβ标记的Aβ斑块表现出响应极性差异而变化的荧光寿命。
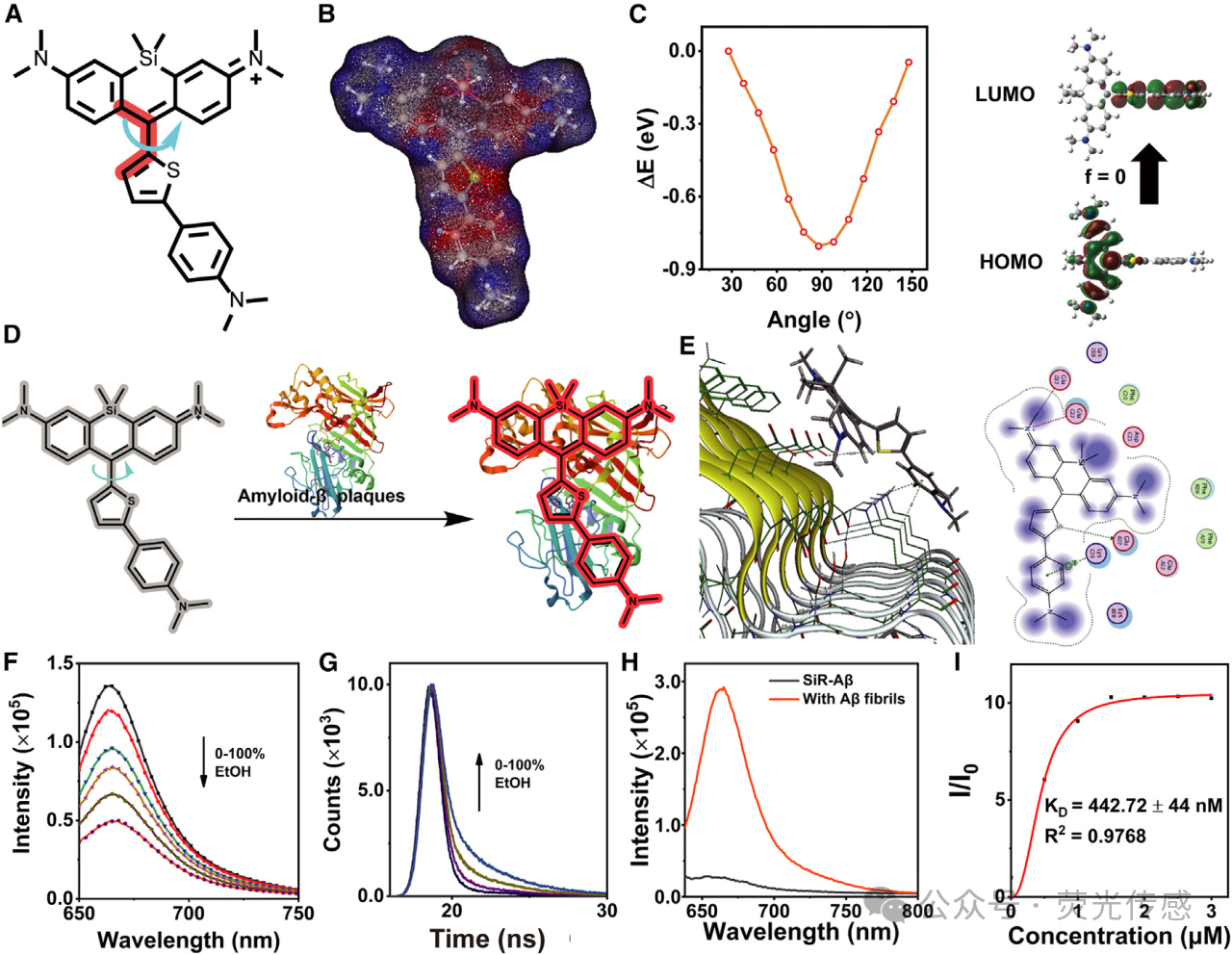
图2. SiR-Aβ结构和与Aβ斑块的结合动力学(A和B)SiR-Aβ的分子结构和电子构型。(C)SiR-Aβ的势能和电子状态。(D)示意图突出了SiR-Aβ和Aβ斑块之间的结合相互作用。(E) SiR-Aβ与Aβ原纤维结合的计算分析。(F和G)SiR-Aβ(5 mM)在不同乙醇浓度下的荧光强度和寿命光谱。(H) 将SiR-Aβ(5mM)的荧光光谱与Aβ原纤维(20mM)的光谱进行比较,以提供详细的光谱分析。(I) 图显示了pH 7.4的PBS溶液中SiR-Aβ浓度与Aβ原纤维(10mM)之间的关系。
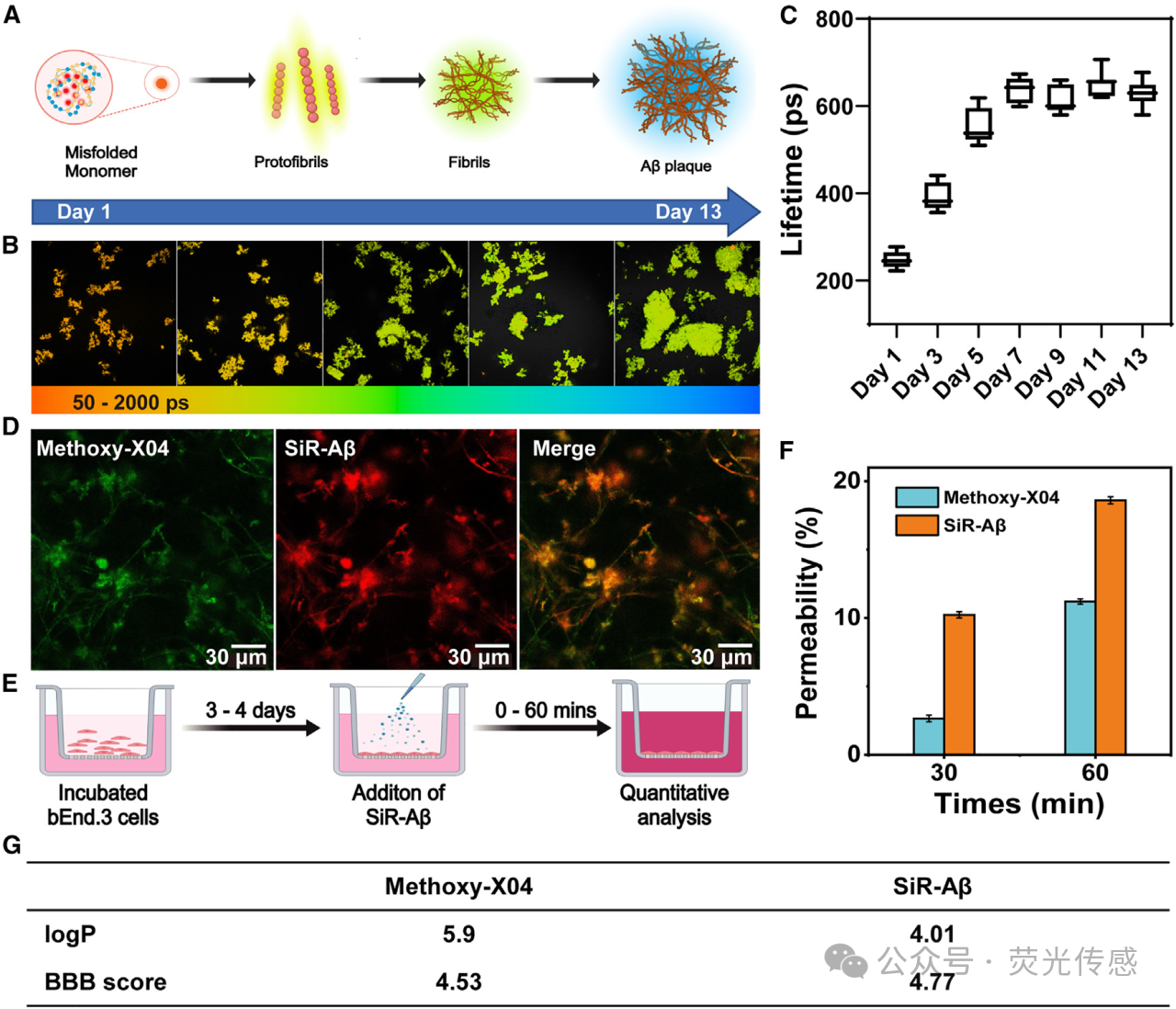
图3. 脑切片中SiR-Aβ的组织渗透性和BBB渗透性分析(A)Aβ斑块聚集过程中极性的改变。(B) 通过FLIM分析显示Aβ斑块聚集的进展。(C) Aβ斑块聚集过程中荧光寿命的时间变化。(D) 用甲氧基-X04(绿色)和SiR-Aβ(红色)对AD小鼠的相邻脑切片进行染色的组织学比较。(E) 体外血脑屏障模型和使用Transwell进行渗透性评估的示意图。(F) SiR-Aβ和Methoxy-X04在体外BBB模型中的通透性比较。(G) SiR-Aβ关键物理化学性质概述。
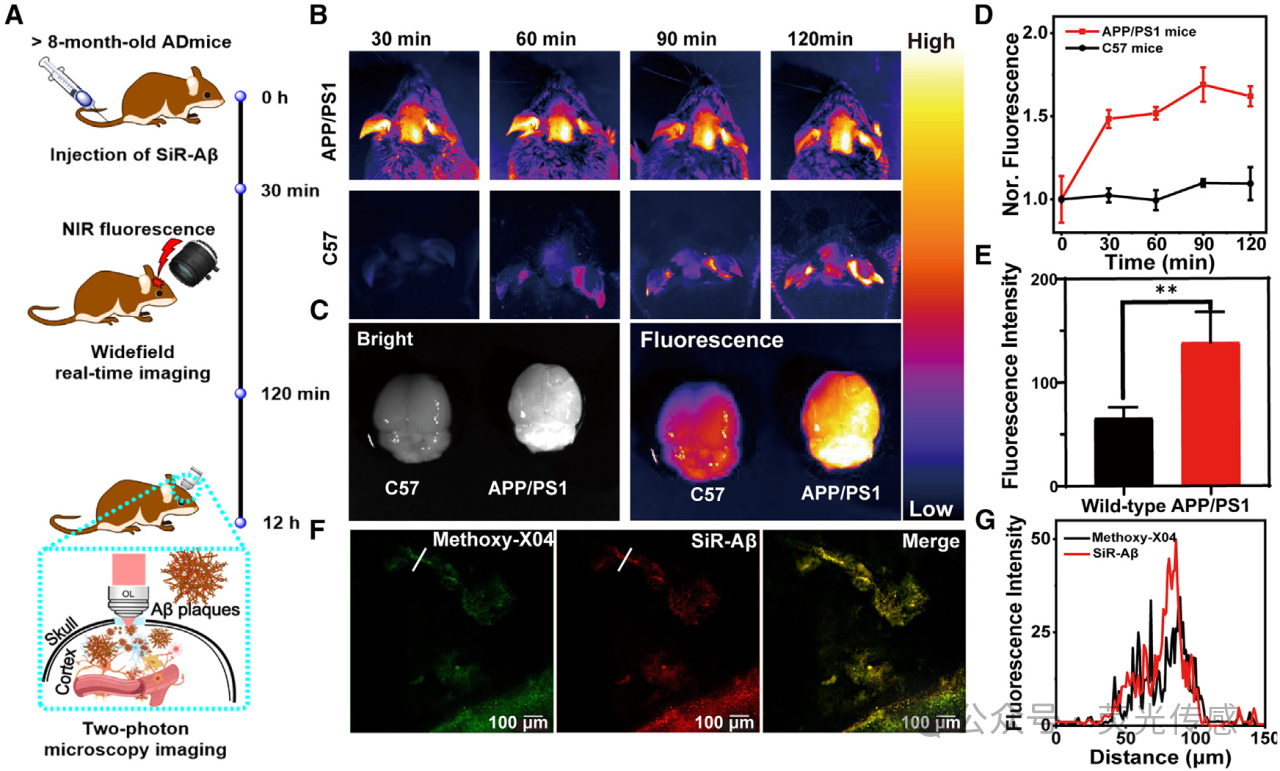
图4. Aβ斑块的FLIM(A)SiR-Aβ的近红外荧光成像协议。(B)时域广角脑成像。(C) 静脉注射SiR-Aβ(2mg/kg)120分钟后,对C57和AD小鼠的大脑进行离体成像。(D) C57和AD小鼠大脑的相对荧光强度(I/I0)显示在不同时间点。(E) 脑荧光强度的统计分析(n=5;双侧检验;**p<0.01)。(F) SiR-Aβ和甲氧基-X04的共孵育用于体内成像。使用甲氧基-X04的488nm和SiR-Aβ的635nm激发波长获取荧光图像。(G)线轮廓显示了(F)两个通道的荧光强度分布曲线。
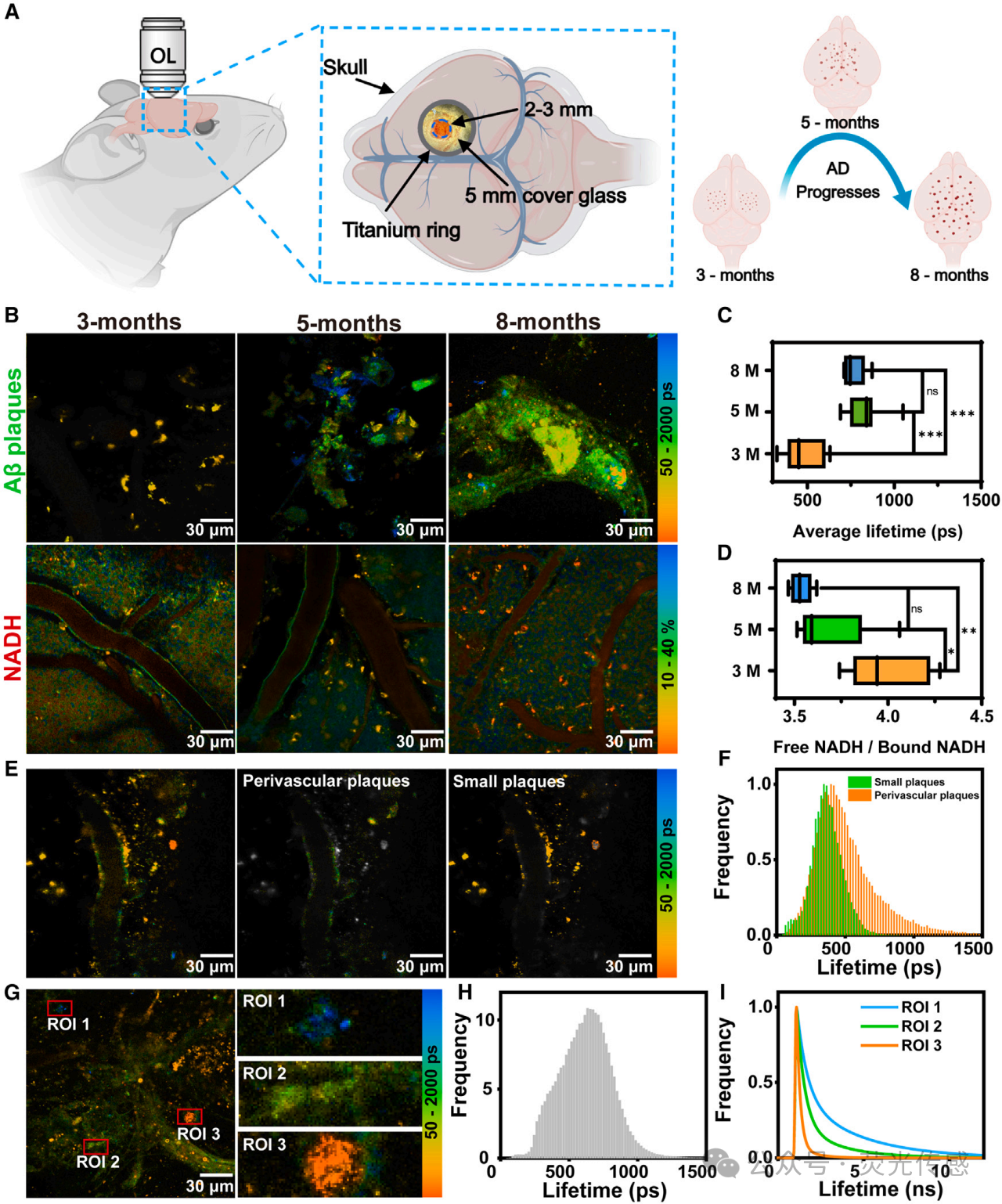
图5. 用SiR-Aβ(A)成像方法标记的Aβ斑块的FLIM和斑块生长示意图。(B) 年龄特异性AD小鼠中Aβ斑块和NADH的FLIM。(C) 斑块中平均荧光寿命的年龄依赖性分布。(D) 游离NADH和结合NADH比率的年龄依赖性分布。(E) 8个月龄AD小鼠血管附近Aβ斑块的FLIM。(F) 血管附近发现的斑块和较小斑块的荧光寿命分布。(G) FLIM显示8个月龄AD小鼠大斑块的局部放大。(H) 大斑块的荧光寿命分布如(G)所示。(I) 三个不同放大区域的荧光衰减曲线。
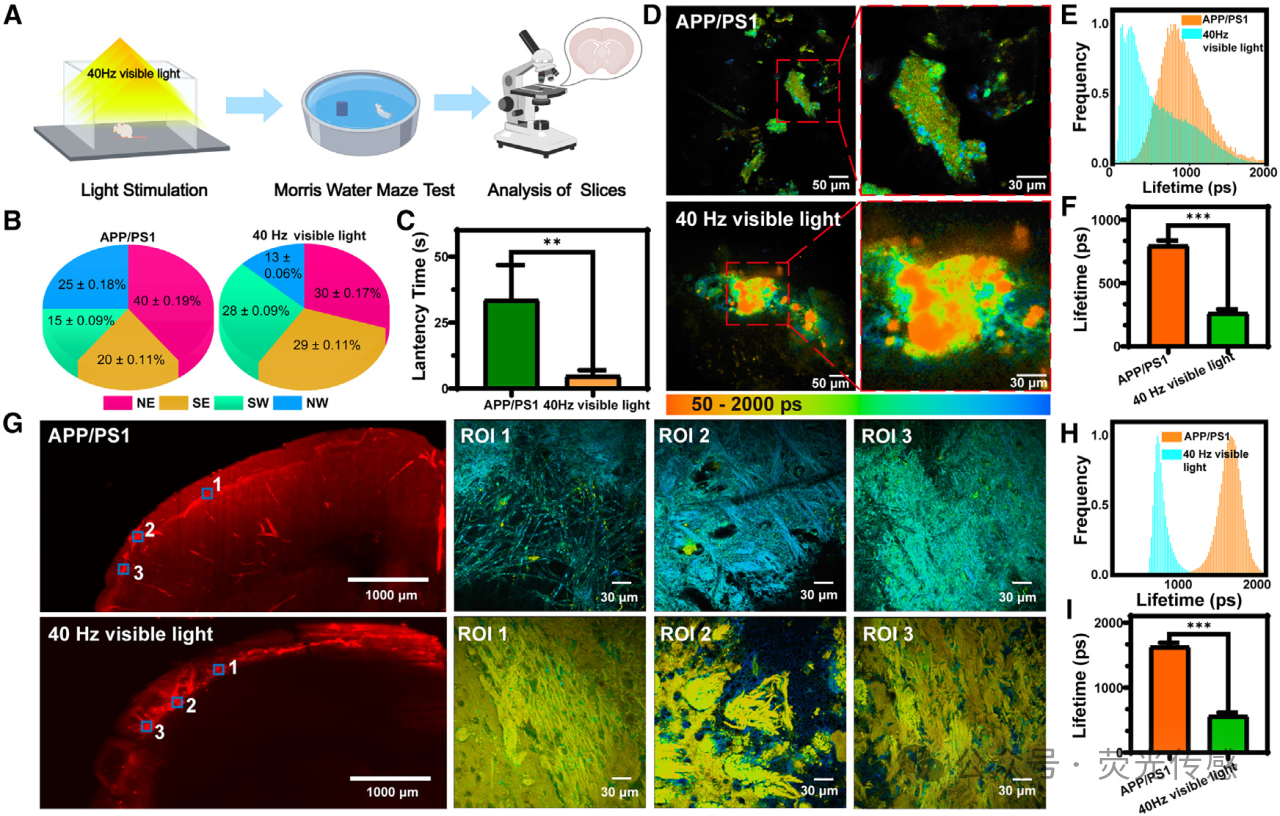
图6. APP/PS1小鼠和用40 Hz可见光(A)治疗的小鼠中SiR-Aβ的行为评估和离体FLIM,用于PBM治疗和行为评估。(B) 在空间探索过程中在象限中花费的时间。(C) PBM对Morris水迷宫潜伏期的影响。(D) 脑组织的活体FLIM成像比较。(E) 小鼠组间荧光寿命分布的差异。(F) 比较荧光寿命分析。(G) 脑切片的离体荧光和FLIM成像。(H) 小鼠组间荧光寿命变化的分布。(I) 荧光寿命变化分析。
本研究确立了SiR-Aβ作为一种有前景的荧光寿命探针,用于动态监测AD转基因小鼠体内的Aβ斑块极性。重要的是,作者发现了PBM诱导的极性逆转,这可能与减少Aβ斑块负担和行为改善有关。这项研究为Aβ清除机制提供了新的视角,并为开发AD的治疗策略提供了新方向。
文献链接:https://doi.org/10.1016/j.matt.2025.102102
点击“阅读原文”直达上述文章
该设备由深圳大学生物医学光子学研究中心、凯佳光科联合研发,欢迎测样。