『能源光电子』Optica 工程院士清华戴琼海教授:扫描光场层析成像实现高速高分辨率各向同性三维成像


随着组织清晰技术的快速发展,越来越多的生物应用需要对大型透明样品进行整体成像,特别是在毒理学、神经科学和发育生物学等领域。尽管光片荧光显微镜(LSFM)在这方面得到了广泛应用,光学投影层析成像(OPT)作为一种经典的低成本成像技术,特别适用于厘米级样品,如清晰的器官、活体胚胎和植物。OPT的基本原理与计算层析成像相似,它通过从不同方向将三维体积投影到二维平面来捕捉光强分布,然后通过滤波反投影重建三维结构。为了实现高分辨率,OPT通常需要高数值孔径(NA)物镜,这限制了单视图成像的景深(DOF)。这一限制使得传统OPT系统在大重建体积中维持高分辨率面临挑战。在需要高分辨率成像的大范围场景中,往往需要对大规模样品进行轴向扫描,这导致成像速度与同时实现大规模和高分辨率成像之间的长期权衡。
此外,为了满足高分辨率的需求,校准和重建技术不断得到改进,采用越来越精确的模型。通过刚性重对准算法,可以纠正由系统误差引起的简单光学像差和机械伪影。然而,由于非均质样品和变化的成像条件引起的复杂光学像差问题,依然对高分辨率重建产生不利影响,并且这一挑战仍未得到解决。此外,迭代重建方法通过在三维体积中引入点扩散函数来补偿由于简化投影模型造成的分辨率损失。因此,目前没有现有的OPT系统能够实现大型体积样品的高速整体成像。
为了解决这个问题,清华戴琼海院士团队提出了一种紧凑的低成本方法,即扫描光场层析成像(SLiT)系统,用于对大型样品进行高速高分辨率的整体三维成像,具有近乎各向同性的分辨率。通过用扫描光场检测替代OPT的宽场检测[图1(a)],可以将每个视点的景深提高超过10倍,而无需额外的轴向扫描来提高成像速度。6×6×6 mm³的大体积内的光子能够高效聚焦用于三维重建,而传统OPT中仅有来自单个二维层的光子有效。此外,由于扫描光场检测提供的4D空间-角度信息,SLiT的重建过程只需24个投影,而传统OPT则需要数百个,从而进一步提高了成像速度。为了进一步解决由于非均质厚样品导致的三维非均匀像差对成像分辨率的降低,我们引入了基于之前数字自适应光学(DAO)的多共轭数字自适应光学(MDAO)技术。该技术通过一个多层模型,纠正由于复杂光学像差引起的多个视点之间的图像不匹配,该模型之前用于天文学中纠正地面层大气湍流。基于此,清华大学戴琼海院士团队开发了迭代多视图相位空间去卷积(IMPD)方法,将多视图去卷积与通过MDAO的三维像差校正结合,以实现近乎各向同性的高分辨率三维重建(𝑥, 𝑧∼17µm, 𝑦∼10µm)。整个6×6×6 mm³的体积可以在30秒内获取。与激光扫描共聚焦显微镜(LSCM)相比,SLiT提高了成像速度,使得6×6×6 mm³的体积图像在仅30秒内获取,无需拼接。我们在多种样品上展示了SLiT的多功能性和优势,如斑马鱼血管、清晰的小鼠脑、血管染色的清晰小鼠眼和骨染色的清晰小鼠头部。凭借其高成像速度和对光学像差的强鲁棒性,相信SLiT可以广泛应用于大型透明样品的整体成像。

整体成像大型透明样品或清晰组织在肿瘤学、神经科学和发育生物学等广泛生物应用中需求旺盛,以了解细胞在器官水平上的功能和组织。然而,传统方法通常由于缺失锥问题和空间上不均匀的光学像差而面临分辨率下降。此外,在高分辨率成像过程中,通常需要在小景深(DOF)下进行密集的轴向扫描。清华大学戴琼海院士团队在本文中提出了一种方法,称为扫描光场层析成像(SLiT),能够在30秒内快速成像6×6×6mm³的大型样品,达到近各向同性的细胞分辨率(𝑥, 𝑧∼17µm, 𝑦∼10µm)。通过与共聚焦显微镜在多种样品上的成像性能比较,验证了SLiT的多功能性和可靠性。SLiT以高成像速度和对异质三维像差的强鲁棒性,为大型透明样品的整体成像提供了具有竞争力的替代方案,为探索多个器官之间的大规模细胞间组织和相互作用提供了新的可能性。

-
提出了一种紧凑的低成本方法,即扫描光场层析成像(SLiT)系统,用于对大型样品进行高速高分辨率整体三维成像,近乎各向同性分辨率。
-
扫描光场可将每个视点的景深提高超过10倍,而无需额外的轴向扫描来提高成像速度。
-
6×6×6 mm³的大体积内光子能够高效聚焦用于三维重建,而传统OPT中仅有来自单个二维层的光子有效。
-
开发了迭代多视图相位空间去卷积(IMPD)方法,将多视图去卷积与通过MDAO的三维像差校正结合,近乎各向同性的高分辨率三维重建。
-
SLiT提高了成像速度,使得6×6×6 mm³的体积图像在仅30秒内获取,无需拼接,展示了SLiT的多功能性和优势。

方法
-
A. SLiT光学系统
SLiT系统中检测组件的机械设计基于水平扫描光场显微镜,通过可旋转的样品支架实现多视图数据收集[见图1(a)。样品发出的光场通过物镜捕捉并投影到置于成像平面的微透镜阵列上,传感器位于后焦平面。由于衍射极限或不确定性原理,快照中固有存在空间分辨率和角分辨率之间的权衡。这一限制常常导致传统光场显微镜中的横向分辨率降低。然而,通过采用扫描伽伐尼进行成像平面的横向扫描,能够有效缓解由于每个微透镜尺寸较小而引起的频率混叠,从而显著提高空间分辨率。为了减少杂散光和背景荧光,并最小化光漂白,我们采用选择性体积照明以扩展DOF,覆盖大视场。通过简单更换物镜,可以调整分辨率和体积大小以满足样品要求。使用2×/0.055NA的物镜,SLiT可以捕捉6mm×6mm×6mm的体积。与OPT中采用的宽场采集相比,扫描光场检测显著增强了成像的DOF[图1(a)]。对于高分辨率成像,如斑马鱼血管成像,使用5×/0.14NA的高放大倍物镜,捕获2.4mm×2.4mm×2.4mm的体积。相反,对于更大的体积,如整个小鼠头部,可以使用1×/0.025NA的低放大倍物镜,获取12mm×12mm×12mm的体积。
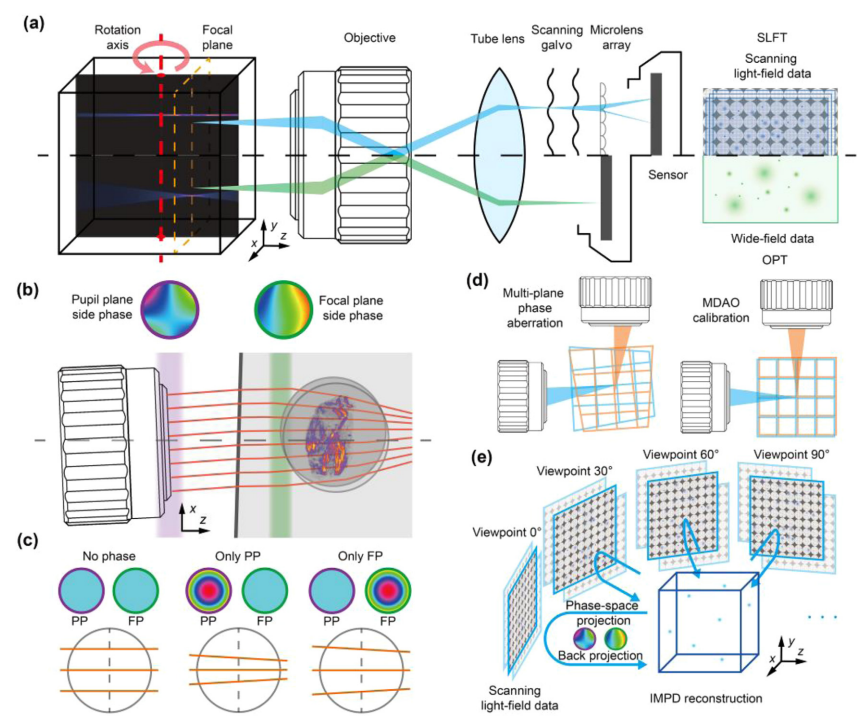
图1 SLiT原理及性能表征
-
B. 由MDAO引导的IMPD重建
学像差被建模为由不同深度的多个虚拟相位板引起的三维变形。相位板是用于修改光通过时的相位轮廓的透明板。通过在无像差光学系统的模拟中添加虚拟相位板,可以说明像差对成像结果的影响。旋转系统中的像差进一步受到样品前面随机、厚且非均匀的成像环境的增强[图1(b)]。为了简化,这里我们仅假设像差存在于两个层面:瞳孔平面侧相位(PP)和焦平面侧相位(FP)。通过在这两个位置插入虚拟相位板,可以模拟这种像差的影响。根据傅里叶定理,在瞳孔平面上的线性相位调制会导致成像平面的横向偏移,这相当于焦平面重建结果的反向横向偏移。在焦平面上的线性相位调制会引入焦平面上光场的倾斜,而不产生任何偏移。考虑到放置在PP或FP上的凸透镜的相位,图像将在成像平面上看起来放大,并在体积中呈现透视变换[图1(c)]。因此,由厚重的非均匀成像环境产生的像差与光场的非耦合偏移和倾斜相结合。与多平面相位模型相比,传统的单平面相位模型在生成光场的偏移或倾斜方面能力有限,使得校正三维非均匀像差变得困难。
为了通过多相位平面像差校正恢复各向同性高分辨率[图1(d)],我们开发了一个多视图融合与去卷积管道。对于MDAO,两个数字模拟的相位调制器设置在物镜与样品之间,一个靠近焦平面,另一个在瞳孔平面。两个相位调制的组合能够产生光场的非耦合偏移和倾斜。将估计的相位调制应用于每个视点的模拟过程,能够重现或校正多视图像差,促进来自多个视图的光强信息的准确融合[图1(d)]。每个视点的三维像差信息被建模为由光线引导的非线性几何变换。通常,几何光学不用于建模微观光学系统,因为系统规模不足以忽略波长的规模。然而,在中观系统中,它提供了可接受的估计,其简单性在格式和计算上促进了低成本的重建。考虑到光场的连续特性,Zernike系数被用来对多共轭相位进行参数化。
IMPD基于DAOSLIMIT中的相位空间迭代去卷积方法,该方法包含相位空间和反投影步骤[图1(e)]。相位空间投影步骤是将估计的体积投影到光场测量中,而反投影步骤则利用测量值与前向投影之间的误差来更新三维体积。然后,三维体积在每个视点上进行迭代更新。与单视图光场重建相比,光学像差对多视图的影响更大,这将导致高分辨率下不同视点之间的体积匹配严重不一致[图1(d)]。为了解决这个问题,MDAO被引入到相位空间迭代重建算法中。在相位空间和反投影步骤中,考虑了多共轭相位引起的三维像差,这些像差在前向和反向投影过程中均被纳入考量[图1(e)]。
-
A. MDAO增强了重建性能
为了评估SLiT的性能,对分散在1%琼脂糖凝胶中的1µm直径荧光微球进行了三维成像,使用了2×/NA 0.055的物镜。在没有MDAO校正的情况下,多个视角之间存在严重的匹配不佳,伴随强烈的伪影和低分辨率。经过MDAO校正后,多视角可以被修正并以更高的空间分辨率对齐,且无伪影出现[图2(a)–2(f), 可视化1]。进一步计算SLiT重建中微球的半高全宽(FWHM),发现横向轴向分辨率几乎相同(𝑥, 𝑧∼17µm, 𝑦∼10µm),并且在整个体积中保持一致,结合了多点三维像差校正[图2(g)]。不同视角的估计相位如图2(h)所示。视角之间的对齐以及与重建结果的相关性证明了MDAO估计的有效性和合理性。
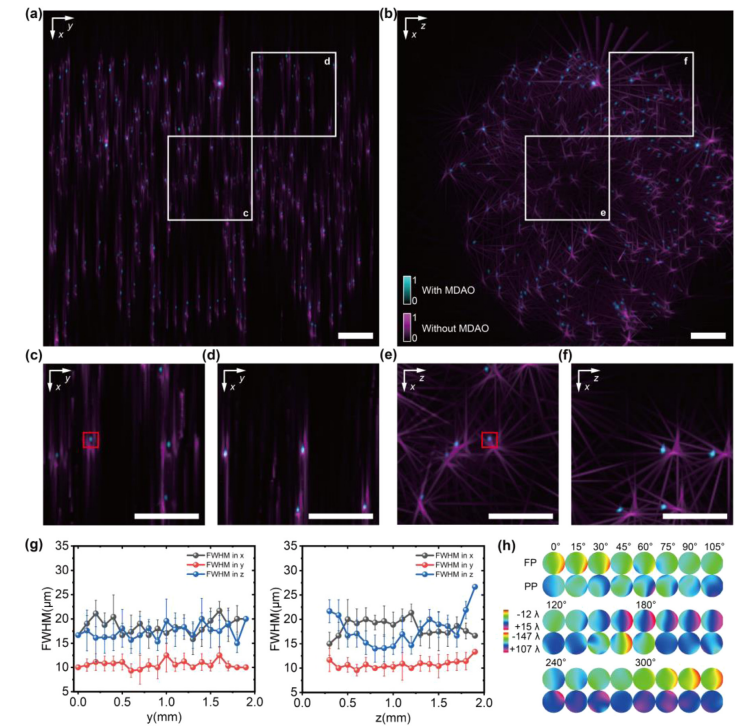
图2
-
B. 在活体样本上成像性能的比较
为了进一步评估SLiT在生物样本上的性能,使用5×/NA 0.14的物镜对发育中的斑马鱼血管进行了大体积成像。同时,我们还用4×/NA 0.13的激光扫描共聚焦显微镜(LSCM)对同一样本进行了成像,以便进行比较。我们使用的斑马鱼株系为fli1a,专门在血管中表达增强型绿色荧光蛋白,成像时间约为受精后2.5天。在数据采集期间,斑马鱼被嵌入在与水折射率匹配的1%琼脂糖凝胶中。扫描光场数据在30秒内从24个视点捕获。
SLiT和LSCM(从0°视角捕获)的数据均进行了手动配准以便比较[图3(a)。尽管LSCM的结果表明SLiT的保真度,但由于样本散射,LSCM未能成像鱼的背部眼部。SLiT的成像速度远快于LSCM,并且由于旋转过程,其轴向分辨率甚至更高。各种视图的最大强度投影(MIP)显示了详细的血管结构[图3(b)]。某些不匹配可能是由于LSCM的像差以及在样本存储期间活斑马鱼的生长所致。在90°视角下,由于前组织散射,LSCM图像在鱼的背部变得模糊。生成的切片堆栈揭示了血管结构和层析能力的细节[图3(c)]。几个子体积进一步放大,以显示SLiT的分辨率提升[图3(d)和3(e)]。在0°视角下,SLiT中以黄色显示的血管回路与LSCM通常共享相同的结构。然而,在45°和90°视角下,由于低轴向分辨率,LSCM结构变得模糊,而SLiT继续显示清晰的结构。
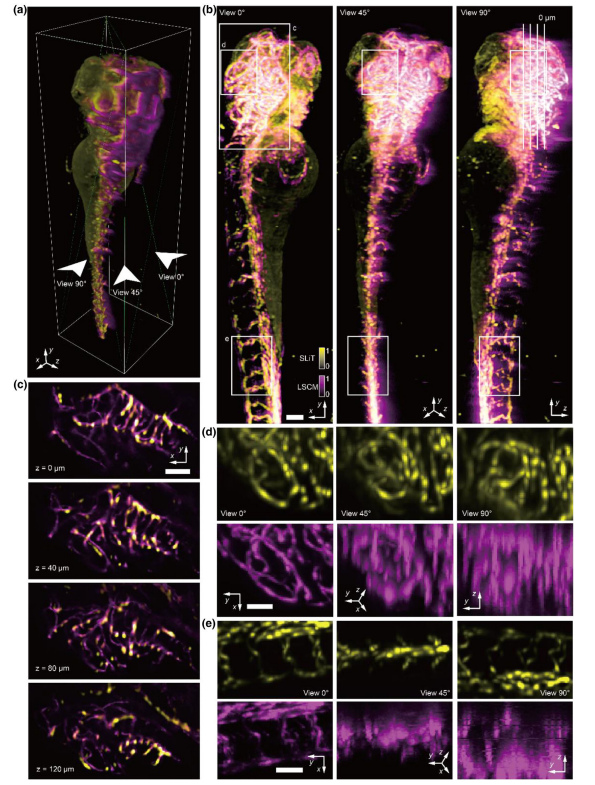
图3
-
C. 大规模清除组织的高速整体成像
为了进一步展示SLiT在大规模清除组织上的优势,我们对几种不同类型的样本进行了成像,例如清除小鼠脑中的神经元(图4,图S8)、清除小鼠眼中的血管(图4,图S7)以及清除骨染色小鼠头部的成像(图5)。通过SLiT,我们能够在短时间内获得高分辨率的三维成像,捕捉到细胞层面的详细结构。这些结果表明,SLiT在处理大规模透明样本时,不仅提高了成像速度,还显著改善了图像质量,克服了传统成像方法在处理厚样本时的局限性。SLiT系统在生物样本的多样性和复杂性方面表现出了出色的适应性,为未来在生物医学研究中深入探索细胞组织的功能和相互作用提供了新的可能性。
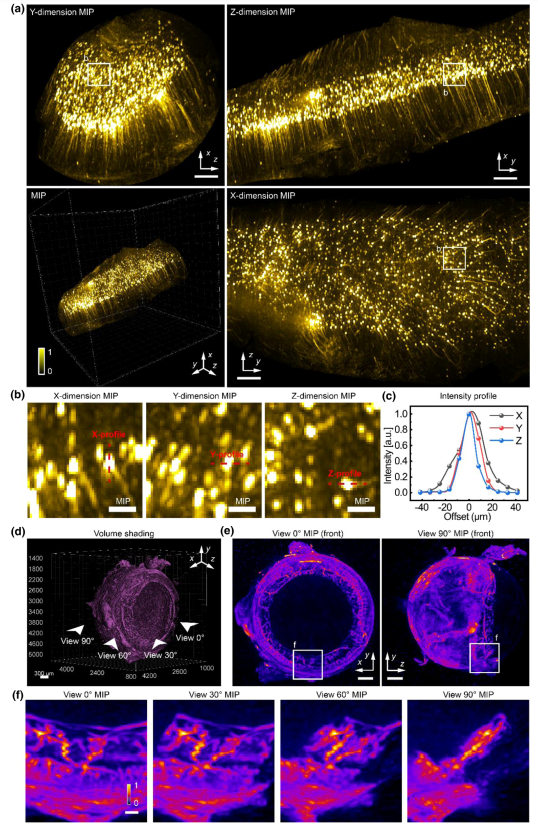
图4
在清除的小鼠脑层4皮层中,使用SLiT技术对标记有黄色荧光蛋白(Thy1-YFP)的神经元进行了成像,采用2×/NA 0.055的物镜,捕获了24个视点,以重建一个6mm×6mm×6mm的体积(图4)。正交最大强度投影(MIP)清晰地显示了神经元的形态,能够从各个方向详细观察轴突(图4(a))。为了对神经元进行更详细的检查,我们提取了一个子体积,并使用MIP展示(图4(b))。提取的强度曲线显示出几乎各向同性的空间分辨率,范围在15到20 µm之间(图4(c))。相同系统设置应用于清除小鼠眼中的血管,血管使用番茄Lectin(DyLight 488)标记。重建的体积渲染结果显示了眼睛的经典结构,包括虹膜和脉络膜(图4(d)。为了特意突出虹膜的血管,体积被切半并通过MIP呈现(图4(e))。虹膜和脉络膜的血管清晰可见。随后提取的子体积使用MIP展示(图4(f),显示虹膜血管在所有视角下均清晰可见,展示了其特有的锯齿形状。
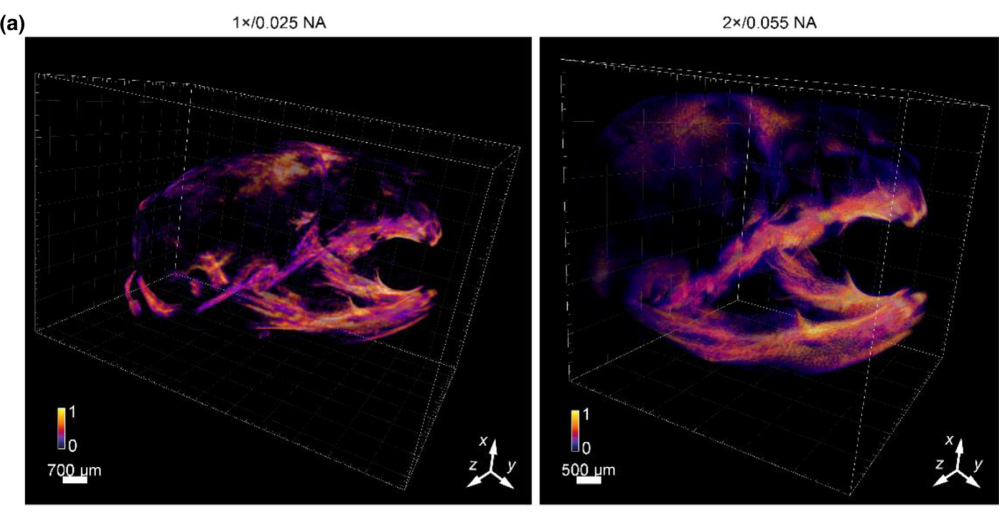
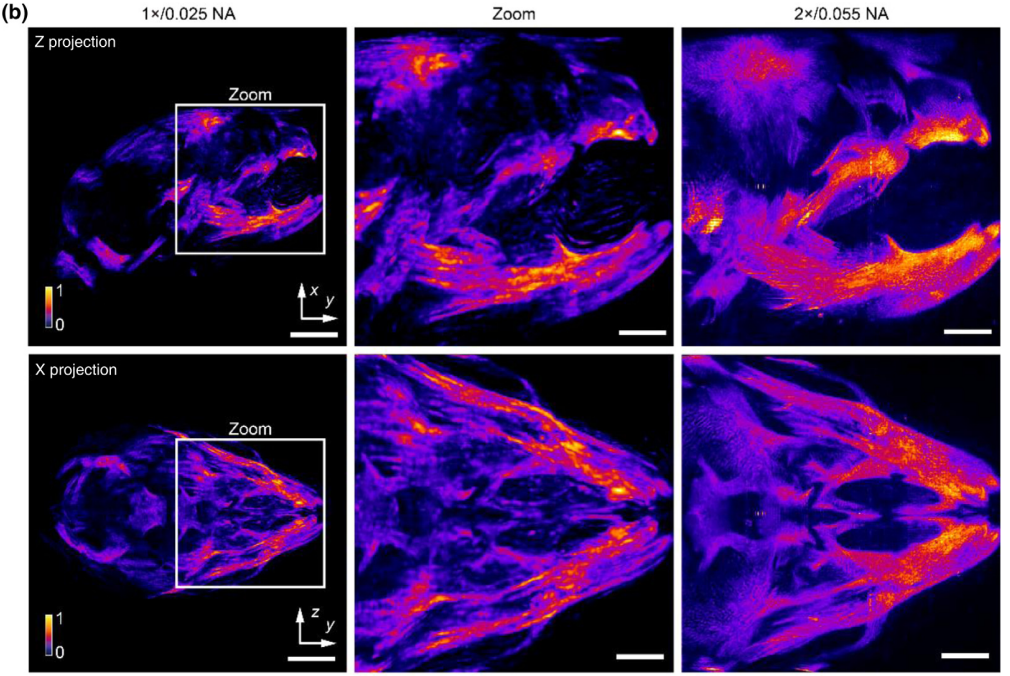
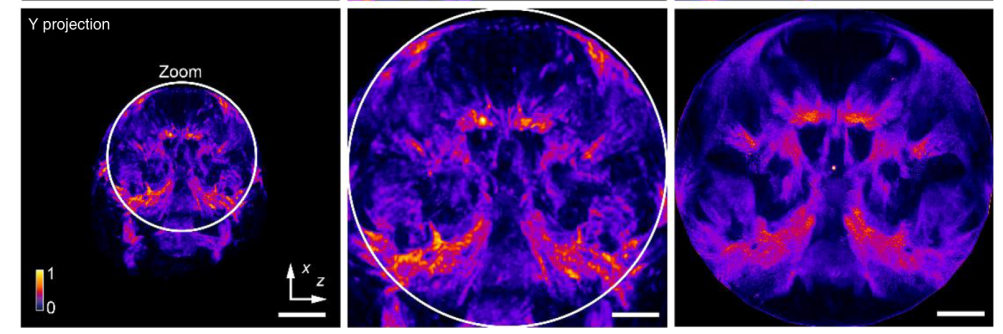
图5
不同的发育样本对成像的规模和分辨率要求差异很大。SLiT能够灵活适应样本要求,通过不同的物镜配置获得多种成像范围和分辨率。同时,SLiT在成像过程中能够很好地适应不同的染色和透明度方法,并提供相等质量的成像结果。为此,我们对双染色的阿利扎林红-阿尔西安蓝新生小鼠头骨进行了成像,采用2×/NA 0.055的物镜在6mm×6mm×6mm的体积范围内和1×/NA 0.025的物镜在12mm×12mm×12mm的体积范围内进行成像(图5)。我们比较了使用1×和2×物镜获得的混合渲染图像和MIP成像结果(图5(a))。小鼠头骨的整体三维结构在1×和2×物镜之间保持一致,表明不同配置的可靠性。此外,2×的结果显示出比1×结果更复杂的结构,这可能归因于2×物镜的更高NA。

以往对中尺度透明器官成像的研究,通常采用光学投影断层成像(OPT)或光片荧光显微镜(LSFM)。然而,OPT的深度范围受到数值孔径(NA)的限制。在需要高分辨率的情况下,高NA物镜的配置导致成像体积小,因此这种方法在细胞分辨率的中尺度成像中并不实用。LSFM通常是一种逐层采集的方法,为了在整个体积中达到高的轴向分辨率,通常需要在中尺度成像中使用拼接光片。此外,对于某些散射样本,还需要耗时较长或更复杂的多视角采集。SLiT将OPT与光场成像相结合,显著增强了每个视点的深度范围,同时保持了分辨率。同时,单视角的三维成像能力使得SLiT可以仅通过少量视角完成重建。与光片显微镜相比,光场显微镜不依赖于选择性照明来提高轴向分辨率,因此不受照明条件恶化的影响,这些特性可以显著减少大规模透明样本的成像时间。因此,SLiT有潜力成为快速成像中尺度透明组织的重要工具。
在SLiT的配置中,视点数量影响成像速度和重建结果的质量。为了考察视点数量的影响,清华大学戴琼海院士团队在模拟的珠子模型上测试了不同视点数量的重建结果(见图S5)。大多数珠子可以用24个视角重建,明显优于使用SLiT的单视图重建(输入𝑥,𝑦,𝑧∼15µm,24视角,重建𝑥,𝑦,𝑧∼15µm;单视图重建𝑥,𝑦∼15µm,𝑧>200µm)。尽管使用八个视角的模拟重建的统计FWHM显示出相当的性能(图S5(b)),但许多珠子仍未重建(图S5(d))。此外,在所有重建结果中,均方误差和峰值信噪比曲线主要在24个视角下收敛。此外,使用SLiT对斑马鱼血管的成像结果表明,与24个视角相比,使用4个视角的重建在特定方向上可以获得更好的分辨率。然而,这可能导致三维结构中的伪影,而不能在整个体积中实现真实的各向同性分辨率。
研究人员还验证了迭代次数对重建质量的影响。过多的迭代可能导致SLiT性能下降,因为所收集的数据包含无法完全校正的相位差异,导致重建过程中强度分布的过拟合。在SLiT中,这种现象在𝑥和𝑦维度中比在𝑧维度中更为频繁,因为圆柱样本的表面在𝑥和𝑦维度中引入了更复杂和更强烈的像差。在重建过程中限制迭代次数有助于保持结果的有效性。
SLiT的分辨率受到物镜NA的限制,无法成像更细小的样本,如神经元突触。此外,低NA物镜的光收集效率低,意味着进一步提高图像采集效率是不可能的。通过提高成像光场系统的NA,可以改善分辨率并减少成像时间。这将使SLiT成为具备亚细胞分辨率能力的更具吸引力的工具。
SLiT系统在很大程度上解决了传统OPT中成像范围有限的问题。然而,其成像体积仍受限于单次采集的范围。像MOST拼接这样的技术提供了几乎无限的成像范围。因此,在未来,研究人员将探索结合来自不同空间位置的成像结果,以增强该方法的可扩展性,实现更大的成像体积。此外,当前方法的重建速度无法满足扩展规模成像任务的需求。克服这一瓶颈涉及基于感兴趣区域的选择性三维重建,利用深度学习方法进行三维重建,并进一步增强计算能力以加快重建速度。

Yifan Chen, Jiamin Wu, Bo Xiong, Zhi Lu, Yuduo Guo, Yi Zhang, Jiaqi Fan, Guihua Xiao, Guoxun Zhang, Xiaopeng Li, Xukang Wang, Zhifeng Zhao, and Qionghai Dai, "High-speed in toto 3D imaging with isotropic resolution by scanning light-field tomography," Optica 11, 1445-1453 (2024)
免责声明:本文旨在传递更多科研资讯及分享,所有其他媒、网来源均注明出处,如涉及版权问题,请作者第一时间联系我们,我们将协调进行处理,最终解释权归旭为光电所有。