超分辨显微镜:全景式看细胞
传统三维超分辨显微镜发展出现瓶颈
超分辨率显微镜的高速发展为生物学家观察亚细胞水平上的动态生命过程提供了前所未有的工具。然而,现有超分辨显微技术的时空分辨率、光毒性以及成像维度之间相互制约,从而限制了这些技术在活细胞成像中的应用。
其中,以高空间分辨率与高时间分辨率之间的矛盾最为明显,主要原因是更高的空间分辨率往往会消耗更多的光子数,而更多的光子数一方面需要耗费更长的积分时间,另一方面会导致更严重的光毒性。因此,光激活定位显微镜(Photoactivated Localization Microscopy,PALM)/ 随机光学重建显微法(stochastic 0ptical ReconstructionMicroscopy,sT0RM)和受激发射损耗显微镜(stimulatedEmission Depletion,sTED)技术虽然能够提供十纳米级别的分辨率,在活细胞中的应用却非常有限。
另外,基于这些技术发展起来的三维成像技术也都存在时间分辨率低、光毒性大等缺点。除此之外,MINFLUX超分辨技术对光子数的要求更低,且时间分辨率可以达到100 μs,但是成像视场非常小,实际应用中难以窥见细胞、甚至细胞器的全貌,因此应用场景也十分受限。
真核细胞中细胞器、生物大分子及其组装体之间相互作用的动态可视化是研究细胞各类功能的关键证据。然而,这些亚细胞结构并不局限于二维平面,而是分布在三维空间中。因此,如何实现快速、长时程的三维超分辨成像对于研究这些亚细胞结构之间的相互作用至关重要。
目前,传统的三维超分辨显微镜通过逐层轴向扫描来获取样品在三维空间的超分辨图像,从而限制了系统的时间分辨率。另外,荧光超分辨率显微镜也存在几个缺点:一是分辨率的提升是以光毒性提高为代价的,因此对活细胞成像持续时间很短;其次,由于荧光探针的宽激发光谱和发射光谱范围,一般不能同时成像超过4种颜色,也很难实现同时多种细胞器的多色超分辨全景成像。尽管Jennifer Lippincott-Schwartz研究组展示了在同一个细胞内用荧光标记6种细胞器,这种实现方式的细胞状态很可能受到标记过量荧光探针的影响,成像的时间空间分辨率都有限。因此研发一种长时程活细胞超分辨高速全景三维显微成像技术是十分必要的。
以定量相位成像为代表的无标记成像技术,不受限于外源标记物引入的限制,在生物医学研究中有着广泛的应用。光学衍射层析(Optical diffraction tomography,ODT)显微成像是一种新兴的无标记光学显微成像技术,结合定量相位成像技术和衍射层析理论,可对活细胞进行长时间的三维高分辨无损成像,有可能解决上述问题,在生物医学领域有着广阔的应用前景[1]。
与具有特异性能力的荧光成像相比,(无标记)光学衍射层析成像存在以下几点优势:
(1)非侵入性:ODT技术不需要对样品进行固定、染色等步骤,无光毒性、无光漂白,最大程度地降低对样品的污染及损伤;
(2)三维成像:ODT可以提供高分辨率的三维图像,从三维层面获取样品信息;
(3)多通道数:针对同一细胞,在不标记情况下能够同时识别八种以上亚细胞结构;
(4)超长时程活细胞连续成像:能够对活细胞进行数个小时至数周的超长连续时长成像,示意图见图1。
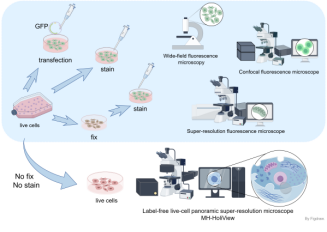
MH-HoliView(无标记)超分辨全景显微镜应运而生
虽然光学衍射层析成像技术无需标记,成像技术优势明显。但是,其光学架构复杂且算法不够成熟,未能大规模应用于生物医学研究中。主要存在以下两方面缺点:一方面,光学衍射层析数据量大,计算过程复杂,难以用于对偶发生命现象的连续观察,所以尚未充分发挥其无标记成像的优势;另一方面,在实现无标记成像的同时,光学衍射层析的特异性成像能力有限,仅能提供形态学的表征,在实际生物学研究中有必要与荧光、拉曼等特异性成像模态结合。
北京大学长三角光电科学研究院全资控股子公司——澄观光学科技(南通)有限公司自主研发的MH-HoliView(无标记)超分辨全景显微镜(见图2),能够实现对活细胞及细胞器的超长时程动态监测。其横向分辨率130 nm,轴向分辨率350 nm,单次最大成像视野大小达到180 μm×180 μm,成像深度可达40 μm,三维成像时间分辨率最高1 s,同时具有超高灵敏度,可识别折射率变化仅为0.0005的生物样品。

同时针对成像系统光路复杂问题,澄观光学优化光路结构,进行小型化、工程化、模块化设计,实现光路的高度集成化,提高稳定性,用户可自由选配宽场荧光成像、双光子荧光成像等模块,降低客户二次购买成像系统的投入成本。
基于该系统可实现活细胞内线粒体、脂滴、核膜、染色体、内质网及溶酶体等多种亚细胞结构的同时高速三维全景成像,可运用于基础生物学、临床医学及病理学、精准药物筛选、精子筛选、人体细胞精准分型等领域,可直接用于研究细胞死亡、细胞器互作、细胞分泌等方向,在活细胞层面看清楚疾病发生的过程和原因。图3是利用MH-HoliView进行活细胞ODT成像的图片及细胞器指示。
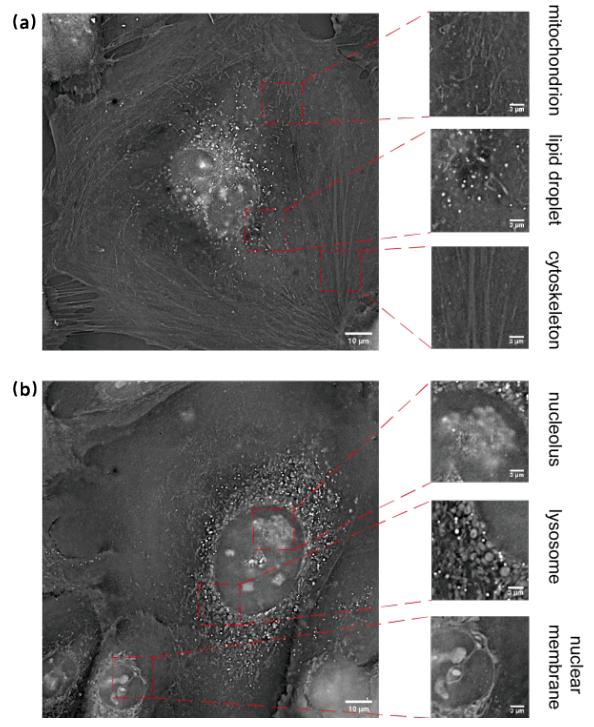
MH-HoliView在生物医学中的应用
1.细胞死亡机制研究
细胞死亡是生命过程中的一个基本现象,正常的细胞死亡(如程序性细胞死亡)在生理过程中起着重要作用,如维持组织稳态、去除老化或受损细胞、调节免疫应答等[2]。而细胞死亡的异常或失调与多种疾病的发生密切相关,包括癌症、神经退行性疾病、心血管疾病等,同时,研究细胞死亡也可以帮助科学家开发更有效的药物,改善治疗效果并减少副作用[3]。
细胞死亡通常伴随着形态的变化,如细胞体积的减小、膜的破裂等。ODT能够非侵入性地测量细胞的折射率分布,从而可以实时监测细胞的形态变化,识别细胞死亡的早期迹象(见图4)。
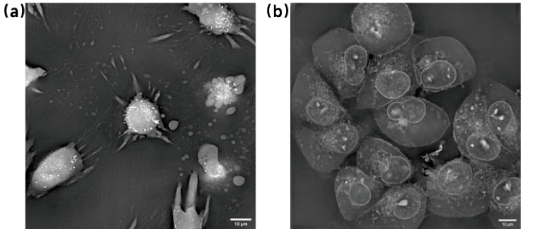
图4 细胞死亡的ODT图片。(a)为细胞凋亡,伴随着细胞皱缩、体积变小、质膜气泡等现象;(b)为细胞焦亡,伴随着细胞胀大、细胞膜破裂、内容物释出等现象
2.药物评价
ODT技术可以应用于药物筛选和疗效评估。在药物研发的早期阶段,ODT技术可以用于评估药物对细胞和组织结构的影响。通过高分辨率的三维成像,ODT能够观察和分析药物处理后细胞或组织的形态学变化、细胞核的形态及大小、细胞器的分布等。这些信息对于评估药物的毒性、有效性和机制具有重要意义。
通过监测药物处理后的细胞或组织结构的变化,可以评估不同药物对于细胞或组织的影响和治疗效果,为个性化治疗和抗感染药物的开发提供支持(见图5)。
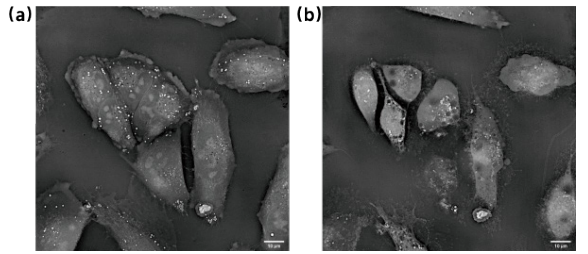
图5 细胞给药前后拍摄的ODT图片。(a)为细胞给药前的状态,细胞膜完整、细胞形态舒展、内部结构清晰;(b)为细胞经过给药处理后的状态,细胞膜破裂、细胞皱缩、内部混浊
3.亚细胞器互作研究
ODT技术能够以百纳米级的空间分辨率对细胞的结构和形态学特征进行成像。通过观察细胞器的形态及分布或者细胞器之间的互作,更好地理解细胞功能和代谢过程,这对于研究细胞生物学、病理学以及药理学的基础研究具有重要意义。图6是细胞器互作图片。
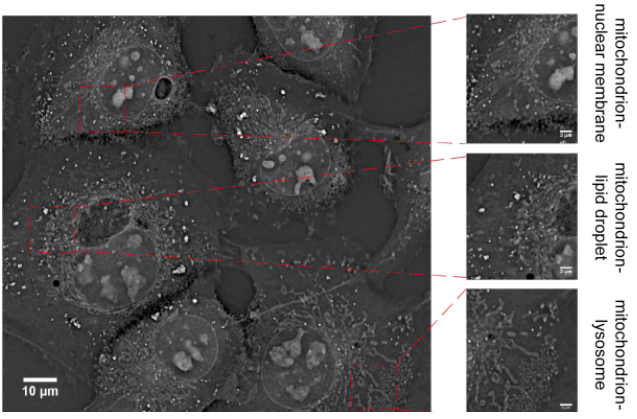
图6 细胞器互作图片。细胞内线粒体与核膜相互作用;线粒体与脂滴相互作用;线粒体与溶酶体相互作用
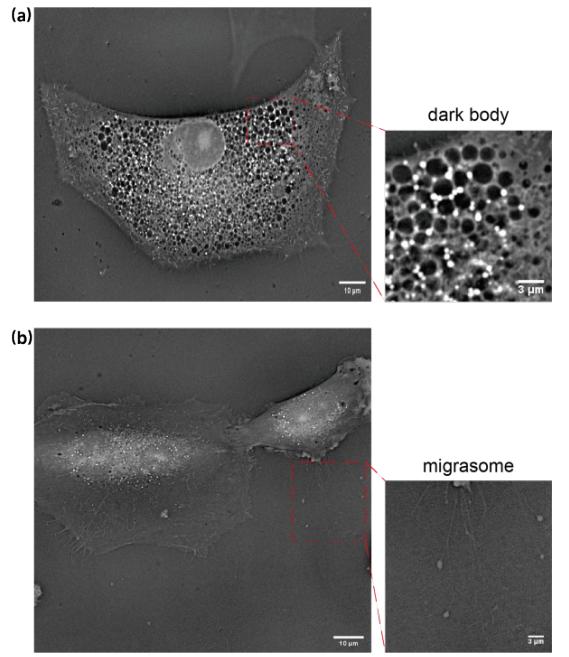
图7 新型细胞器的发现。(a)为黑体,黑体与衰老表型有关,当细胞发生衰老时,黑体会大量增多,且黑体体积会变大;(b)为迁移体,与细胞迁移过程密切相关,迁移体内包含多种细胞器、蛋白质和信号分子,能够影响细胞迁移和细胞间通信
4.细胞之间的物质传输
细胞之间进行物质传输是维持细胞正常功能、响应外界环境变化以及细胞间的能量分配的基本行为[7]。深入研究细胞器传输机制不仅有助于理解基本生物学过程,还对许多疾病(如神经退行性疾病、癌症、代谢疾病等)的治疗具有重要意义[8]。
目前,细胞间物质传输的研究手段还需要通过对目标进行特异性标记,再结合荧光显微镜进行观察,容易产生光毒性及光漂白,影响细胞活性及细胞的传输能力。
ODT能够对样品进行高分辨率的三维成像,可以实时监测到细胞器的动态变化,包括细胞器在细胞间的运输。相比传统的荧光显微镜,ODT不需要染色或标记,因此不会对细胞器的功能和传输过程造成干扰,见图8。
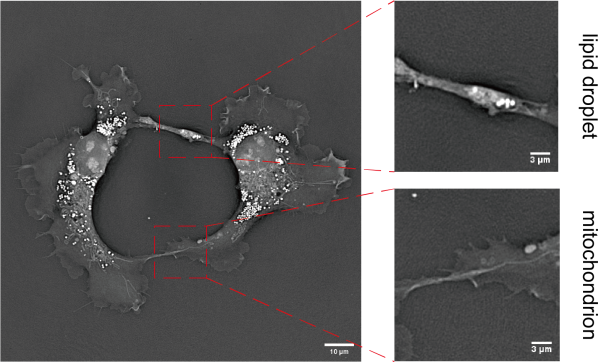
图8 细胞间进行物质传输。细胞间进行脂滴的传输及线粒体传输
5.组织病理学检测
针对组织切片,常用的研究手段主要是通过H&E染色或者免疫荧光染色后,再对样品进行扫描,但是这种方法依赖于制样手法或者染料的特异性,同时会损伤组织样品。
ODT技术能够实现组织样本的三维成像,揭示组织结构的复杂性和微观环境的分布。例如,可以观察到组织内部的细胞排列方式及分布情况等,同时,无需繁琐的制样步骤,最大程度地降低对样品的损伤。这对于研究组织发育、病理过程和治疗效果的评估提供了新的视角和方法,如图9所示。

图9 组织ODT成像图片。(a)为血管组织横切图;(b)为晶状体组织切片图
陈颖,澄观光学科技(南通)有限公司资深应用工程师;
李艳莉,澄观光学科技(南通)有限公司资深机械设计工程师;
冯邱锴,澄观光学科技(南通)有限公司资深光路设计工程师;
李浩然,澄观光学科技(南通)有限公司应用测试工程师;
严钰,澄观光学科技(南通)有限公司应用测试工程师;
施可彬,北京大学教授,兼任北京大学国家生物医学成像科学中心PI。主持国家重点研发计划、国家自然科学基金重点项目、重大研究计划集成项目等,2014-2016 年主持基金委优秀青年基金项目,2021年获得中国仪器仪表学会科技进步一等奖(团体)。
参考文献:
[1] 穆书奇, 董大山, 施可彬. 无标记光学成像技术[J]. 激光与光电子学进展, 2022,59(12):11-31. [2] Newton K, Strasser A, Kayagaki N, et al. Cell death[J]. Cell, 2024,187(2):235-256. [3] Hanggi K, Ruffell B. Cell death, therapeutics, and the immune response in cancer[J]. Trends Cancer, 2023,9(5):381-396. [4] Ma L, Li Y, Peng J, et al. Discovery of the migrasome, an organelle mediating release of cytoplasmic contents during cell migration[J]. Cell Res, 2015,25(1):24-38. [5] Dong D, Huang X, Li L, et al. Super-resolution fluorescence-assisted diffraction computational tomography reveals the three-dimensional landscape of the cellular organelle interactome[J]. Light Sci Appl, 2020,9:11. [6] Liu P, Shi J, Sheng D, et al. Mitopherogenesis, a form of mitochondria-specific ectocytosis, regulates sperm mitochondrial quantity and fertility [J]. Nat Cell Biol, 2023,25(11):1625-1636. [7] Zurzolo C. Tunneling nanotubes: Reshaping connectivity[J]. Curr Opin Cell Biol, 2021,71:139-147. [8] Gerdes H H, Carvalho R N. Intercellular transfer mediated by tunneling nanotubes[J]. Curr Opin Cell Biol, 2008,20(4):470-475.免责声明:本文旨在传递更多科研资讯及分享,所有其他媒、网来源均注明出处,如涉及版权问题,请作者第一时间联系我们,我们将协调进行处理,最终解释权归旭为光电所有。