超导单光子探测器SNSPD助力解析视网膜脂褐素病理特性
年龄相关性黄斑变性(AMD)作为全球老年群体视力丧失的主要诱因之一,其临床诊疗长期面临“早期隐匿、干预滞后”的困境——疾病早期阶段,患者多无明显视力下降或视物异常症状,而当中心视野模糊、黑影遮挡等典型表现出现时,视网膜色素上皮细胞(RPE)与感光细胞的退行性损伤已难以逆转,错过最佳干预窗口。
这一困境的核心症结,在于传统诊断技术难以捕捉AMD早期的分子水平异常。目前临床常用的眼底自发荧光(FAF)成像技术,虽能呈现RPE细胞内脂褐素颗粒(LGs)的分布模式,却无法区分脂褐素的正常生理积累与病理状态下的氧化变质,仅能依赖主观形态分析判断病情,导致早期病变极易漏诊。而脂褐素作为RPE细胞代谢“垃圾”,其氧化产物的异常堆积,正是AMD病理进程启动的关键分子标记,如何精准识别这一“隐形信号”,成为突破AMD早期诊断的核心难题。
近期,发表于生物预印本平台bioRxiv的一项研究提出了创新性解决方案:研究团队将荧光寿命成像显微镜(FLIM)与超导单光子探测器(SNSPD)相结合,构建出一套具备超高灵敏度与定量分析能力的检测系统。该系统可通过捕捉脂褐素荧光寿命、光谱特征的细微变化,精准区分正常脂褐素与氧化变质的脂褐素,实现对AMD早期分子病变的可视化与定量化检测,为破解AMD早期诊断难题提供了关键技术支撑。
一、基础概念
要理解这项技术的突破,首先得认识一个名叫“脂褐素”(Lipofuscin)的物质。它是视网膜色素上皮细胞(RPE)代谢产生的“垃圾颗粒”,随着年龄增长不断堆积,最终形成直径约1-3微米的脂褐素颗粒(LGs),其积累过程与皮肤老年斑的形成机制相似,因此也被通俗地称为“视网膜老年斑”。
从生理功能来看,RPE细胞是视网膜健康的“守护者”:它不仅为感光细胞提供营养支持,还承担着清除感光细胞每天更新产生的外节段碎片的核心任务。但随着年龄增长,RPE细胞的溶酶体降解效率会显著下降,导致部分感光细胞外节段碎片无法被彻底分解,这些碎片中的视黄醇类物质会逐步聚合,最终形成脂褐素颗粒。值得注意的是,脂褐素本身并非“有害物”——健康人群的RPE细胞内也会存在少量脂褐素,但其含有的双视黄醛(Bis-Rets)类物质(尤其是特征性成分A2E),却在特定条件下成为触发AMD病理进程的“关键因子”。
当视网膜暴露于400-700nm的可见光下时,A2E会表现出光敏特性:它会吸收光子能量并激发产生大量活性氧(ROS),这些ROS如同“分子破坏者”,不仅会直接损伤RPE细胞的细胞膜、线粒体等结构,还会反过来氧化A2E,生成毒性更强的氧化型双视黄醛(Oxy-Bis-Rets)。研究数据显示,AMD患者RPE细胞内的Oxy-Bis-Rets含量显著高于健康人群,且这类氧化产物即使在无光照条件下,也能持续破坏RPE细胞的正常功能,加速细胞凋亡——这种“光依赖激活+暗环境持续损伤”的特性,使得Oxy-Bis-Rets成为推动AMD从早期向晚期进展的核心病理介质,最终导致感光细胞失去营养支持而退化,引发中心视力不可逆丧失。
更关键的是,传统眼底检查技术难以捕捉脂褐素的早期病理变化。目前临床常用的眼底自发荧光(FAF)成像技术,虽能通过检测脂褐素的自发荧光信号呈现其在RPE层的分布模式,但无法区分脂褐素的“生理积累”与“病理氧化”状态——无论是正常脂褐素还是富含Oxy-Bis-Rets的病变脂褐素,在FAF图像中均表现为荧光信号,医生只能通过荧光强度的主观对比判断是否存在异常,这使得AMD早期阶段的脂褐素氧化病变极易被漏诊,错失最佳干预时机。
二、超导单光子探测器赋能:
打造“透视”脂褐素的超灵敏检测系统
为破解传统技术无法区分脂褐素生理与病理状态的难题,来自俄罗斯与德国的联合研究团队,构建了一套集成化的超灵敏检测系统——以共聚焦激光扫描显微镜为基础平台,融合时间相关单光子计数(TCSPC)技术与超导单光子探测器(SNSPD),将脂褐素的检测从“可视化”升级为“精准量化”,相当于为眼底诊断配备了能“读取分子信号”的“超高清镜头”。
这套系统的核心突破在于SNSPD带来的“光子级灵敏度”与“时间分辨能力”。传统光学探测器如光电倍增管PMT仅能捕捉荧光信号的强度信息,只能看到有没有光、光有多亮;而SNSPD作为当前最灵敏的光子探测设备之一,可实现对单个光子的精准捕捉,且能记录每个光子从“被激发发光”到“荧光熄灭”的时间(即荧光寿命),其时间分辨率可达皮秒量级,清晰呈现荧光分子的“动态特征”。
不同物质的荧光寿命具有独特性——正常脂褐素中的双视黄醛(Bis-Rets)与病变状态下的氧化型双视黄醛(Oxy-Bis-Rets),其荧光寿命存在显著差异。研究团队利用这一特性,设计了针对性实验:从100例50-75岁无眼底病变捐赠者的眼球中提取RPE细胞来源的脂褐素颗粒(LGs),通过可见光(400-700nm)照射模拟AMD病理进程中的脂褐素光氧化过程,再用这套超灵敏系统对比分析正常与光氧化后脂褐素的荧光特性,最终锁定了三个关键的“病理信号”:
1.平均荧光寿命显著延长。实验数据显示,正常脂褐素的平均荧光寿命(τm)约为0.6纳秒,而经光氧化处理后,这一数值提升至1.1-1.4纳秒。原因在于,Oxy-Bis-Rets的荧光寿命远长于Bis-Rets,其在脂褐素中的占比增加会直接拉高整体平均寿命,这一指标成为判断脂褐素氧化的直接量化依据。
2.荧光光谱出现“蓝移”现象。正常脂褐素的荧光峰值集中在592nm附近(呈现黄橙色荧光),而光氧化后的脂褐素,其荧光峰值向短波方向移动(趋近550-580nm,呈现蓝绿色荧光)。这种“颜色偏移”并非偶然——Oxy-Bis-Rets的分子结构改变使其荧光发射波长缩短,如同树叶因叶绿素减少而变黄,光谱蓝移成为脂褐素病理变化的“视觉标识”。
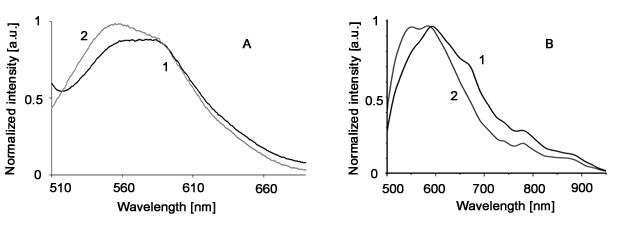
图1脂褐素颗粒(LGs)悬液的荧光光谱:
A-采用静态荧光分光光度计获得的归一化光谱:1-光氧化前的未照射(天然)脂褐素颗粒;2-经可见光(400-700nm)光氧化后的脂褐素颗粒。激发波长:488nm。
B-采用激光扫描仪结合超导单光子探测器(SSPD)获得的归一化拟合光谱:1-未照射(天然)脂褐素颗粒;2-经紫外线(UV)光氧化后的脂褐素颗粒
3.荧光寿命分布异质性增强。正常脂褐素的荧光寿命分布较为集中,呈现单峰或窄峰特征,类似整齐排列的队列;而光氧化后的脂褐素,其寿命分布曲线变得宽散且出现多个峰值。这一现象暗示脂褐素光氧化过程中产生了多种结构不同的Oxy-Bis-Rets,每种氧化产物具有独特的荧光寿命,导致整体分布呈现“多峰混乱”状态,反映出脂褐素病理变化的复杂性。
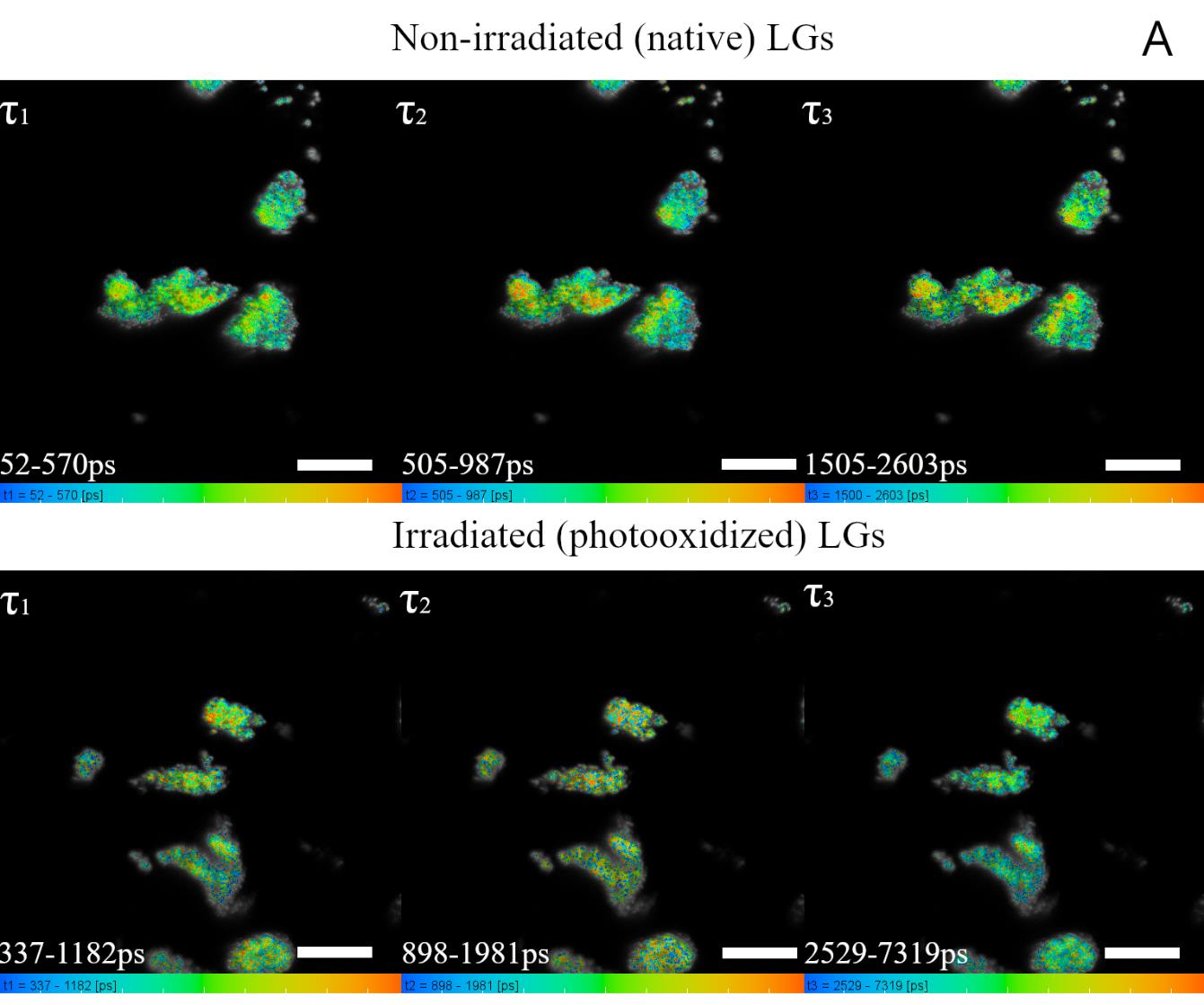
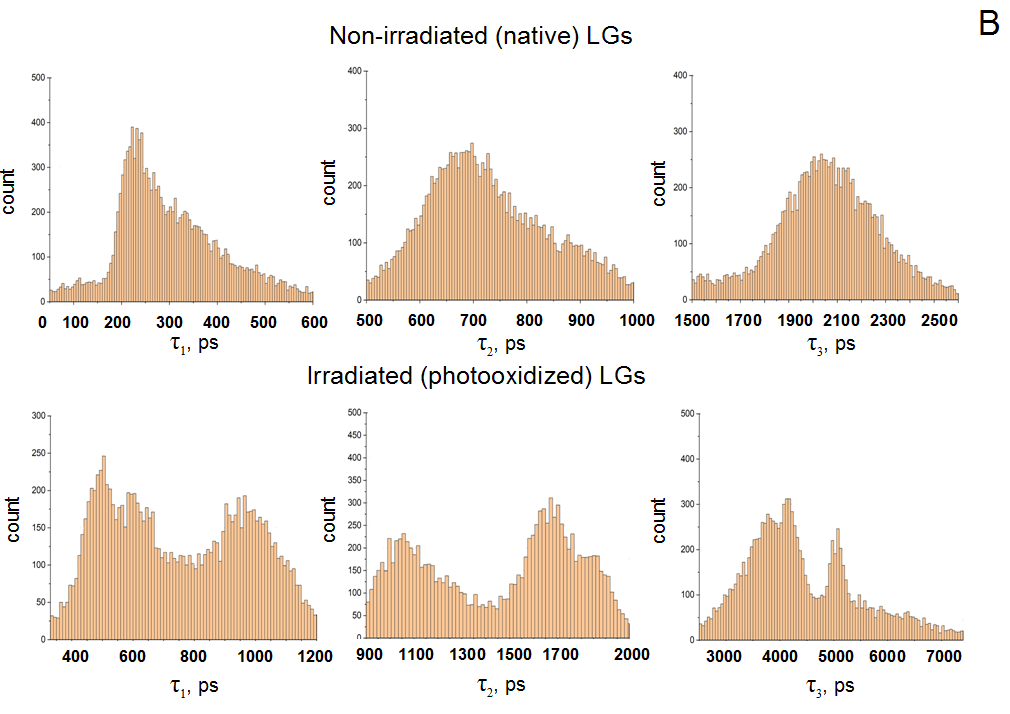
图2(A)脂褐素颗粒(LGs)样品光氧化前后,其寿命τⱼ的空间分布可视化图。
(B)脂褐素颗粒(LGs)光氧化前后,样品中各τⱼ组分的荧光寿命分布直方图
三、50岁后的视力筛查
这项研究的意义不仅在于基础科学突破,更在于为临床诊断提供了可量化的“金标准”。研究团队提出,未来50岁以上人群的视力筛查可以重点关注三个指标:
1.平均荧光寿命(τm)
健康人群的视网膜黄斑区脂褐素平均荧光寿命应低于0.8纳秒,如果超过1.0纳秒,就需要警惕AMD的早期风险。这个指标就像血压一样,是客观可测的“健康数值”,避免医生主观判断的误差。
2.长寿命组分占比(A3)
脂褐素的荧光信号可以分解为三个组分:短寿命(τ1≈0.2纳秒)、中寿命(τ2≈1.0纳秒)和长寿命(τ3≈4.0纳秒)。其中长寿命组分主要来自Oxy-Bis-Rets,健康人群中A3占比约4-7%,如果超过10%,说明毒素积累已经比较严重。
3.光谱峰值位置
正常眼底脂褐素的荧光峰值在590-600纳米之间,如果峰值向550-580纳米移动(蓝移),即使没有明显视力下降,也可能是AMD的早期信号。
研究团队还发现,这些指标比传统的FAF成像更灵敏。在模拟实验中,当Oxy-Bis-Rets含量增加15%时,FAF成像还看不出明显变化,但超灵敏显微镜已经能检测到荧光寿命和光谱的异常。这意味着,未来通过这项技术,医生可以在AMD症状出现前3-5年就发出预警,为干预治疗争取宝贵时间。
四、从实验室到临床
虽然这项技术展现出巨大潜力,但要真正应用到医院的眼科诊室,还需要解决几个关键问题:
1.设备小型化
目前的超灵敏显微镜系统体积庞大,需要专业实验室环境,无法直接用于临床检查。研究团队计划与医疗器械公司合作,开发便携式的“眼底荧光寿命成像仪”,方便医生在门诊使用。
2.建立大样本数据库
这项研究使用的是捐赠眼球的脂褐素样本,还需要在活人体内进行验证。研究团队下一步将招募1000名50岁以上的志愿者,跟踪他们的眼底荧光寿命变化,建立不同年龄段、不同健康状况的“正常参考值”,让诊断标准更准确。
3.结合其他检查手段
荧光寿命成像虽然灵敏,但不能完全替代其他检查。未来可能会将这项技术与光学相干断层扫描(OCT)、眼底血管造影等结合,形成“多模态检查套餐”,从结构、功能、分子水平全方位评估视网膜健康。
值得期待的是,这项技术不仅能用于AMD的早期诊断,还可能应用于其他眼底疾病,比如糖尿病视网膜病变、青光眼等。研究发现,糖尿病患者即使没有视网膜病变症状,脂褐素的荧光寿命也会比健康人延长15%左右,这为糖尿病眼部并发症的早期筛查提供了新方向。
五、结语
该研究基于荧光寿命成像显微镜(FLIM)与超导单光子探测器(SNSPD)的技术结合,在视网膜脂褐素的病理特征解析与年龄相关性黄斑变性(AMD)早期诊断研究领域实现了关键突破。其核心价值在于首次通过量化分析脂褐素光氧化前后的荧光寿命、光谱特征及寿命分布异质性,为AMD的早期病理标记物识别提供了客观数据支撑,也为眼底退行性疾病的分子水平诊断开辟了新路径。
尽管当前研究仍处于预临床阶段,但这项技术为解决AMD“早发现难”的临床痛点提供了新的方向,也为未来通过精准检测守护中老年人群视网膜健康、延缓视力衰退带来了可行的研究思路。
论文链接:
https://doi.org/10.1101/2025.09.12.675809