多光子显微成像
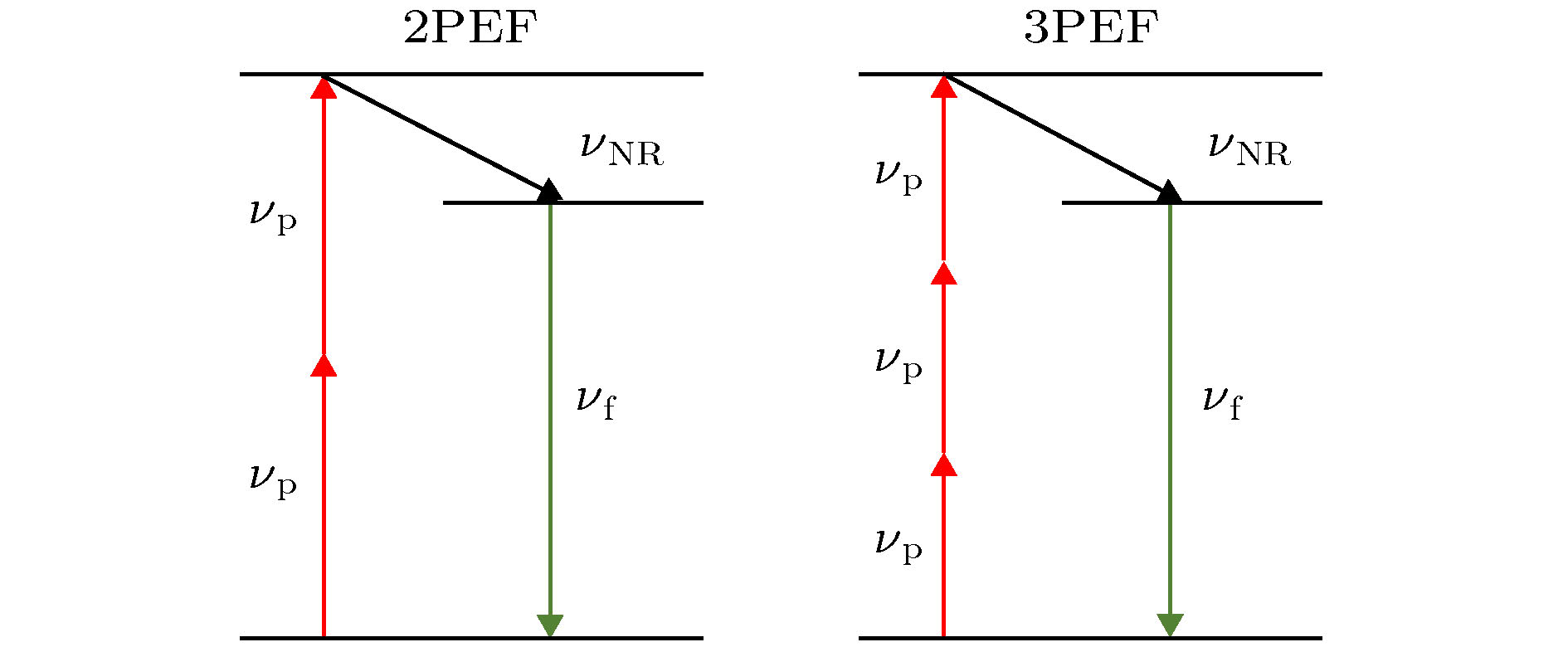
多光子激发是指在具有高光子密度的入射光激发下, 处于基态的分子/原子同时吸收多个光子后跃迁到激发态, 经过弛豫过程跃迁到亚激发态, 最后自发辐射回到基态, 释放出频率略小于多倍入射光频率的荧光光子. 1990年Denk等开发了第一台双光子激光扫描显微镜后, 多光子成像就以其低侵入性、高穿透性、高空间分辨率等优势走进人们的视野. 目前最常见的多光子成像技术是双光子激发荧光(two-photon excited fluorescence, 2PEF)和三光子激发荧光(three-photon excited fluorescence, 3PEF)成像,

德国Class5飞秒激光器

西班牙Radiantis超快激光系统

美国Coherent激光器
双光子显微成像技术是一种超高分辨率的成像技术(双光子显微技术最早于1990年提出),它可以在活体状态下对大脑中的单个神经元和树突棘进行成像,由于仪器的微型化,该技术有可能实现自然行为条件下的大脑成像。
要理解双光子显微成像技术必须要先科普几个概念。
单光子激发:在激光照射下,基态荧光分子或原子吸收一个光子后成为激发态,随后又弛豫到某一基态,同时以光子形式释放能量而发出荧光,这一过程就是通常的单光子激发情况。
双光子激发:一个分子或原子可以在同一个量子过程中同时吸收两个光子而成激发态,这种情况就是双光子激发过程。由于双光子激发所产生的荧光强度与激发光的光强平方成正比,因而与单光子激发的线性过程相比,双光子激发就需要很强的激发光强,这就使双光子激发具有很高的空间局域特点。对于双光子激发而言,只有在焦点处的微小区域内样品才能吸收足够的双光子而发出荧光,因而双光子显微技术具有更高的空间分辨率。此外双光子显微镜的工作波长处在红外区域,使得其在生物体组织内的穿透深度大大提高。
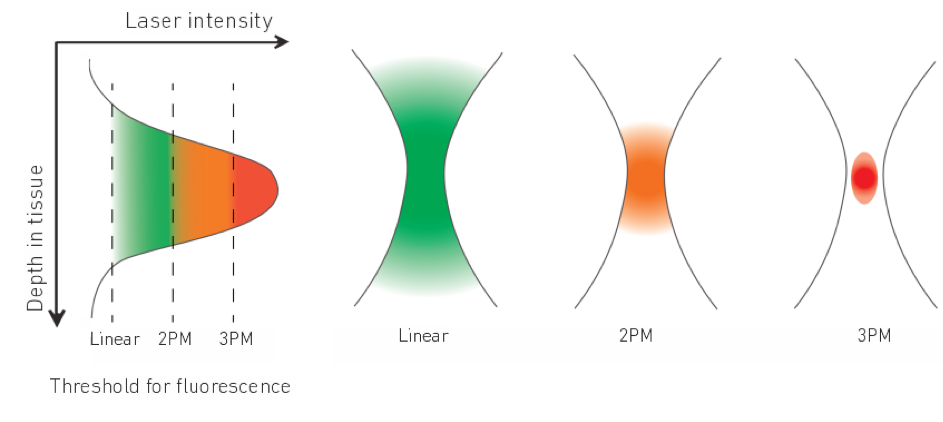
线性荧光显微镜与多光子显微镜(双光子和三光子显微镜)的比较原理。在三光子显微镜中,只有在聚焦中才能达到足够的激光强度以激发三光子吸收,从而产生荧光。这意味着,离焦荧光被抑制,并在深度上实现更好的信噪比。
相较于单光子激发荧光、激光扫描共聚焦和宽场成像等技术, 多光子成像技术具有以下优点:
- 1)多光子成像技术通常采用的激发光为波长较长的近红外光, 相比可见光, 近红外光在生物组织中的穿透能力更强, 能够观察到生物组织中更深层的信息, 侵入性较低;
- 2)多光子成像只有在激发光焦点附近的区域才能激发荧光, 因此多光子成像技术具有天然的光学层析能力, 能更好地对生物组织进行三维成像;
- 3)多光子成像在样品的非焦点区域不产生荧光, 能自动抑制离焦信号, 因而相比宽场成像技术, 多光子成像能实现近乎衍射极限的空间分辨率, 因此能观察到组织内更细微的结构;
- 4)与共聚焦成像技术相比, 多光子成像技术不需要使用针孔滤波, 荧光收集效率高.
多色双光子激发荧光显微成像
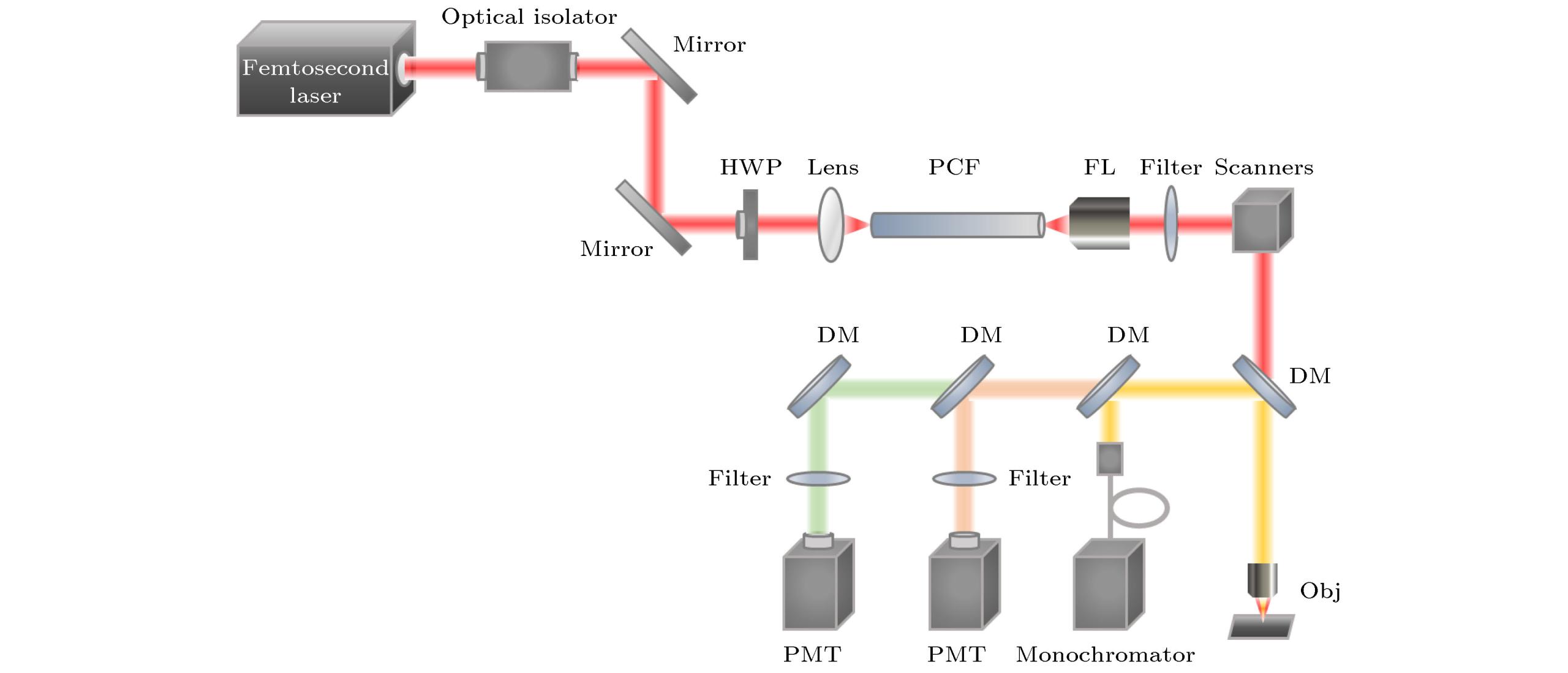
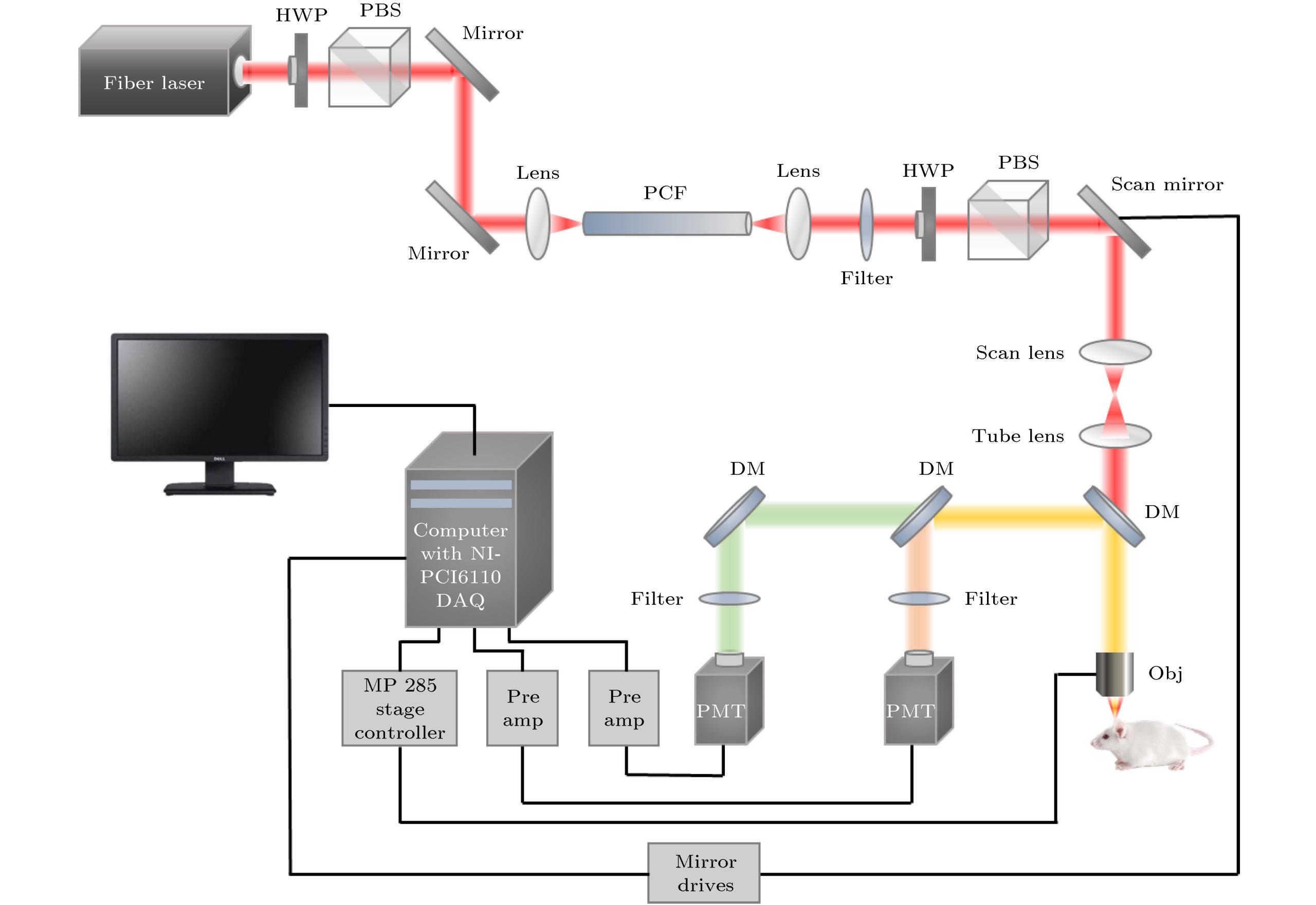
监测人体微环境中细胞、蛋白质、DNA等动态特性和相互作用, 对于活体成像和免疫治疗等研究具有重大意义. 多色荧光显微成像使用具有不同发射光谱的荧光团标记不同的细胞、蛋白质、DNA等, 通过荧光团的光谱信息区分标记样品的类型和功能, 从而实现对多种标记物的动态追踪. 在共聚焦成像中, 单光子多色成像通常采用一个波长激发多种标记物, 但是由于荧光团的单光子激发光谱较窄, 不同荧光团的激发光谱可能相差很大, 所以一个波长难以激发多种荧光团. 相比之下, 常见的荧光团的双光子激发光谱更宽, 不同荧光团激发光谱重叠可能性大, 故多色双光子激发荧光显微成像更容易实现. 图所示为典型的激光扫描多色双光子激发荧光显微成像系统.
多光子显微镜是进行生物医学组织成像的最重要的无标记技术之一,该技术具有亚微米水平的光学分辨率和光学切片的能力。多光子显微镜通过双光子激发荧光通常可以观察到单一的荧光蛋白、染剂或者内源性荧光团,但目前的方法较难实现多个不同荧光团的双光子激发。为了克服上述困难,目前的解决方案包括使用可调谐激光器调谐波长对不同的荧光团顺序成像,再将这些图像重合,或使用一个激光器激发具有重叠光谱的两个荧光团(SLAM)。然而,前一种方法由于成像过程需要切换波长很难实现快速成像,而且切换波长时无法保证样品完全不动,所以多个荧光团各自的图像可能无法完美重叠;后一种方法由于是单一激光波长激发荧光信号,所以不能对每个信号进行独立优化,无法使多个荧光团都被高效激发。
Pierre Mahou等人提出了一种对具有不同吸收光谱的两个或三个荧光团同时进行双光子成像的方法。他们通过同步来自飞秒光学参量振荡器 (OPO) 及其泵浦的脉冲序列,也就是将两束不同波长的激光同时和同空间的聚焦到样品上来实现三色激发 (λ1 (750–860 nm), λ2 (1000–1300 nm)),同步打入两束不同波长的激光时,除了泵浦光束λ1和OPO光束λ2分别激发蓝色荧光团和红色荧光团外,样品还能吸收一个λ1光子和λ2光子,然后产生一个荧光光子,相当于一个虚拟激发波长( λ3 = 2/(1/λ1 +1/λ2 )(850–1000 nm))激发绿色-黄色荧光团,该荧光即为双色双光子激发荧光。通过这种方式即可实现同时双光子激发蓝色、绿色-黄色和红色荧光团,并且可以独立控制它们的激发效率,其中单波长激发的蓝色荧光团和红色荧光团信号可直接通过调节其各自激发光的功率来调节其激发效率,双色双光子激发荧光则可以通过调节两束激光在时间上的延时来控制它的激发效率。该组将该方案用于了活胚胎组织的实时三色双光子激发荧光和三倍频成像。
随着荧光探针和激光光源技术的不断发展, 多色双光子激发荧光显微成像技术也在生物医学中得到越来越多的应用. 而与其他光学成像技术的结合, 如光片显微技术、荧光寿命成像显微技术(fluorescence lifetime imaging microscopy, FLIM)等, 能不断拓宽多色双光子激发荧光显微成像技术的功能及应用领域. 未来随着超短脉冲激光器和信号探测技术的不断发展, 多色双光子激发荧光显微成像技术将会具有更好的应用前景.
双光子激发荧光寿命成像
荧光寿命是指当组成物质的分子在受到光脉冲的激发跃迁到高能级后, 回到基态前在激发态的平均停留时间, 大约为ns量级, 常用τ表示. 荧光寿命是荧光物质的自身属性, 通常与激光的激发强度、光照时间和染料浓度等因素无关, 而与物质自身所处微环境及其本身的结构等条件有关. 由于荧光寿命是荧光分子的固有性质, FLIM技术可以提供比强度、光谱更清晰的荧光染料标记, 并且它包含关于荧光标记的局部分子环境和发色团光物理学的信息, 因此, FLIM技术在成像时具有特异性强和灵敏度高的优点, 能增强生物样品的图像对比度, 而且还可以获取荧光分子所在的微环境中的物理、化学及生物信息. 该技术目前已成为生物学、生物物理学和生命科学领域中研究样品生化性质的有力工具.

意大利FLIM LABS荧光寿命成像
测量荧光寿命的方法主要包括频域法和时域法. 频域法又称相位调制法, 主要有外差法和零差法. 如图所示, 它利用强度按正弦规律调制的激光激发样品, 从而使得样品发出的荧光强度也具有相同的正弦调制频率. 通过测量荧光和激发光之间的解调系数及两者之间的相位差∆φ后可以计算得到荧光寿命值. 而时域法, 也称作脉冲法, 主要有时间相关单光子计数法(time-correlated single photon counting, TCSPC)、门控探测法(time-gated detection)和条纹相机测量法(streak camera)3种实现方式. 时域法测量荧光寿命的方法是利用超短脉冲光源来激发被测样品, 以测量出样品荧光强度的时间衰减规律, 再通过计算或拟合得到寿命. TCSPC是目前测量荧光寿命最常用的方法, 其原理是通过记录激发脉冲过后首个荧光光子到达探测器的时间, 并记录到对应的时间通道中, 多次重复建立一个正比于荧光衰减曲线的光子数-时间分布直方图. 常见的频域法及TCSPC法测量荧光寿命的原理及双光子TCSPC-FLIM成像系统如图所示.
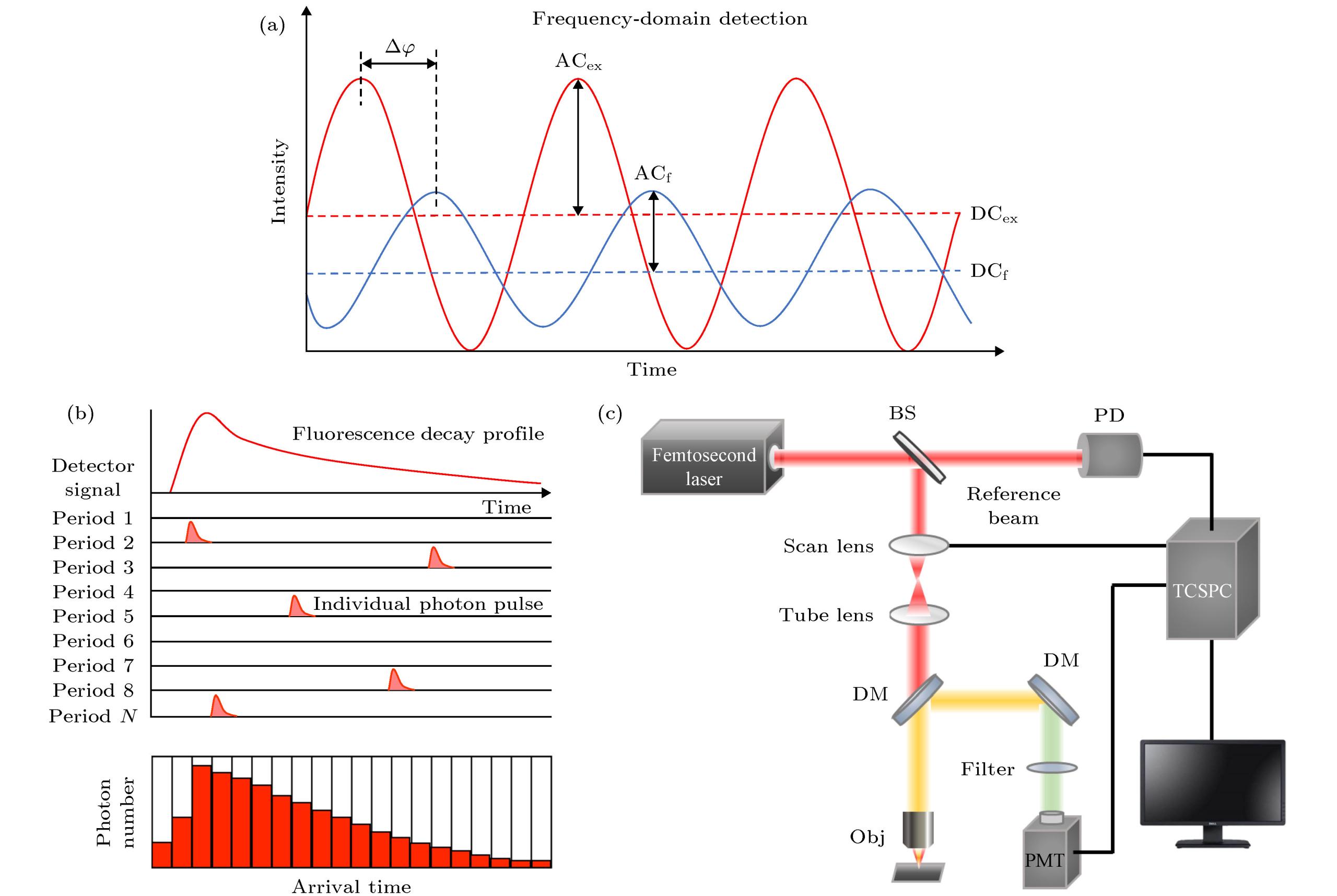
双光子FLIM是将双光子成像技术与FLIM技术的结合, 可获取生物组织的生化特性信息, 同时进行高分辨三维成像, 实现功能和结构的精确定量表征. 两种技术结合的特点在于:
- 1) 双光子FLIM使用的激发波段较长, 穿透深度更大, 能够获取生物样品深层的荧光寿命信息;
- 2) 双光子显微成像技术使用的是脉冲激发光源, 荧光激发效率高, 能满足荧光寿命探测的需要, 而双光子显微成像所固有的层析能力, 能在测量厚样品时避免不同深度信号之间的干扰.
可见, 将双光子成像技术与FLIM技术结合, 拓宽了荧光信息探测模式的维度, 具有广阔的应用前景, 能为生物医学领域提供强有力的研究手段.
尽管双光子FLIM技术已经取得了一系列的研究进展, 但在实际应用中仍面临着一些挑战. 如: 1)双光子FLIM技术系统较为复杂, 成本昂贵, 对激发光源和探测器都有着较高要求, 庞大昂贵的硬件系统限制了双光子FLIM技术在临床医学上的应用; 2) 双光子FLIM技术的穿透深度仍限制在几百微米以内, 难以探测生物组织深层信息; 3) 双光子FLIM技术在数据采集与处理上都较为耗时, 采集一张高分辨率的图像往往要耗时几秒甚至几分钟, 大大限制了该技术的应用. 未来随着激发光源技术、信号采集及数据处理技术的进一步发展, 双光子FLIM技术的性能有望得到进一步的提升.
双光子光纤内窥成像
传统的2PEF虽然能为我们提供生物细胞组织的清晰成像, 但由于其成像系统较复杂, 器件较多, 体积庞大. 并且在现阶段, 大部分对于生物细胞组织的成像仍局限在离体细胞培养, 亦或是局限在生物体表层一定深度. 而生物体内的微环境十分复杂, 体内环境与离体环境差别巨大, 在离体环境下观察得到的结果可能与体内环境相差甚远. 而通过腹窗手术等方法[45]虽然可以实现活体的细胞组织成像, 但这些方法具有高侵入性, 对生物体损害较大, 也不能实现长时间的活体成像, 这些因素都限制了双光子显微镜在活体成像中的应用. 随着光纤内窥技术的不断发展, 双光子光纤内窥成像技术逐渐克服了传统光学显微镜的物理限制, 为长时间活体成像提供了一种有效手段.
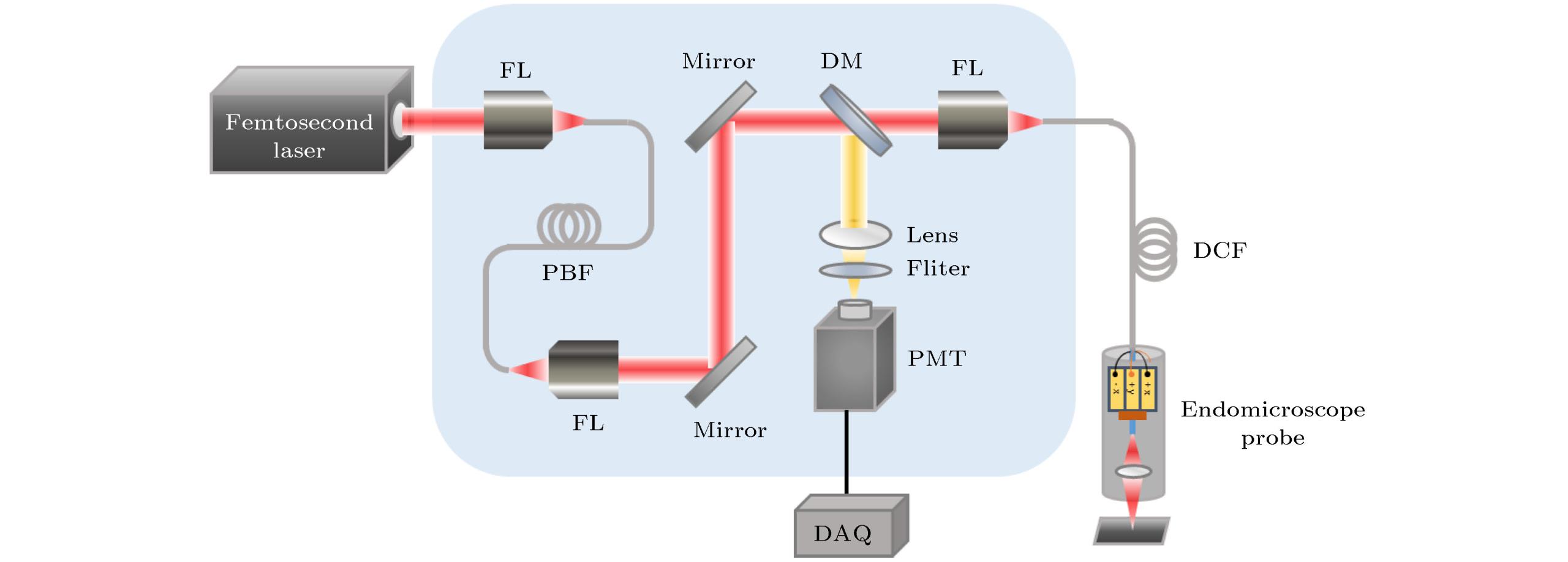
双光子光纤内窥成像在体内组织器官定性与定量检查时具有侵入性低、光损伤小、操作便捷等优势, 是生物医学领域中活体成像研究不可或缺的重要工具. 但目前双光子光纤内窥成像仍面临着如成像分辨率不高、系统尺寸较大、荧光收集效率低等许多技术挑战, 随着PCF与MEMS等技术的发展, 双光子光纤内窥成像技术的性能将得到进一步提升, 从而在生物医学领域中发挥更大的作用.
三光子显微成像
目前, 多光子显微成像技术已成为脑科学研究的重要工具之一, 为了探索大脑的奥秘, 研究者们在不断寻求研究生物体脑内更深层信息. 在用2PEF技术进行脑神经科学研究时, 由于脑内深层组织中散射现象严重, 成像深度受到限制. 尽管采用更长波长的光激发能进一步提高成像深度, 但当焦点处信号荧光强度与背景荧光强度一致时, 成像深度便达到极限. 在小鼠脑中成像深度大约止步于白质层, 很难再往下突破. 一些解决方法, 如插入光学探针, 则会对生物体大脑产生不可逆的伤害. 为了能无损地对脑深层信息进行采集, 人们开始将目光转移到三光子显微成像技术上.

德国Class5飞秒激光器

法国ALPAO自适应光学

赋同量子超导纳米线单光子探测
相较于2PEF, 三光子显微成像具有以下优势:
- 1)常用的荧光蛋白的三光子激发波长更长, 通常为1600—1800 nm, 处于生物组织的最佳红外通光窗口, 在生物组织的穿透效果更好;
- 2)三光子显微成像作为更高阶的非线性成像方法, 不仅具备双光子显微成像的光学切片能力, 同时抑制背景信号能力比双光子显微成像也有所提高.
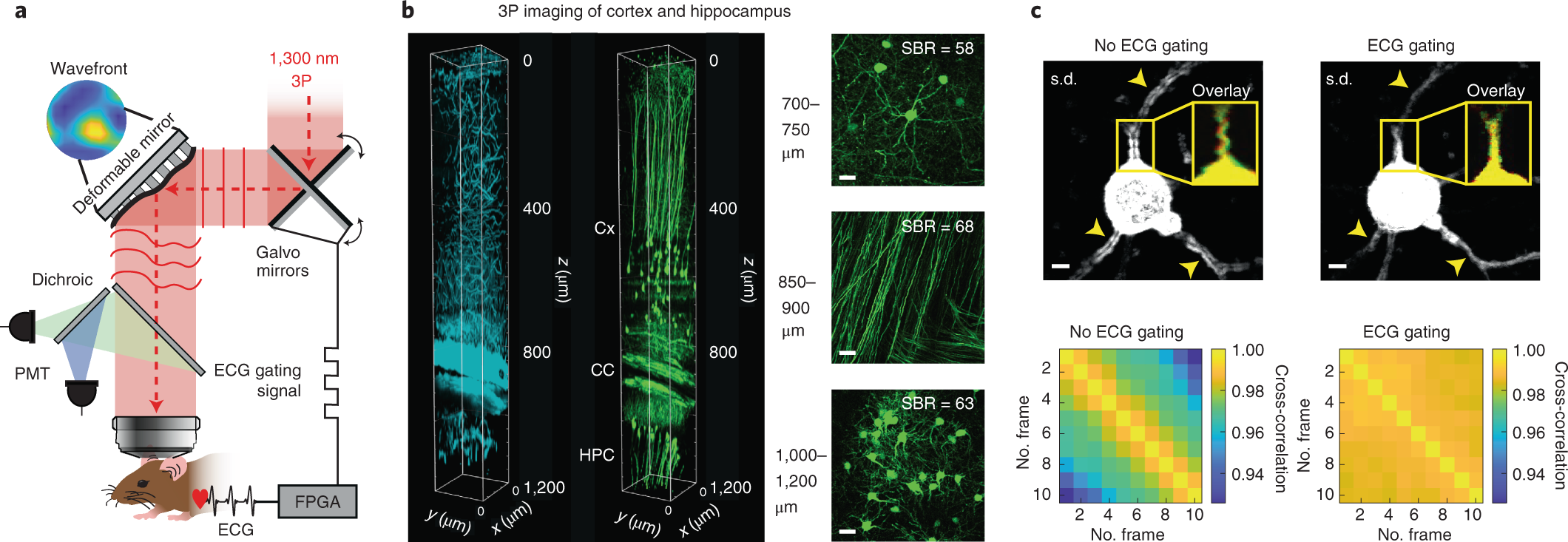
a,运动校正AO 3P显微镜的图示。像差校正是通过基于模态的间接波前传感方法执行的。通过实时ECG门控图像采集方案减少活体运动伪影,该方案将Galvo扫描仪与小鼠的心动周期同步。b,EGFP-Thy3(M)小鼠视觉皮层和海马体中1,300nm激发波长下的1PM。左,三谐波信号(青色)和GFP标记神经元(绿色)的3P图像堆栈的3D重建。右图是海马皮层(Cx;顶部)、胼胝体(CC;中)和CA1区域(HPC;底部)不同深度的最大强度投影图像。不同深度的SBR显示在相应的图像中。比例尺,20 μm。c,比较701μm深度的ECG门控和非门控图像采集的帧内运动伪影。具有(顶部,右侧)和不具有(顶部,左侧)ECG门控的连续采集帧的标准偏差(SD)投影图像。箭头表示帧间变异性高,导致无心电图门控的伪影。黄色框显示两个连续采集的帧(红色和绿色)的叠加。下图,没有(下,左)和有(下,右)ECG同步的单个帧之间的成对二维交叉相关。从n = 4只小鼠获得的代表性数据集。
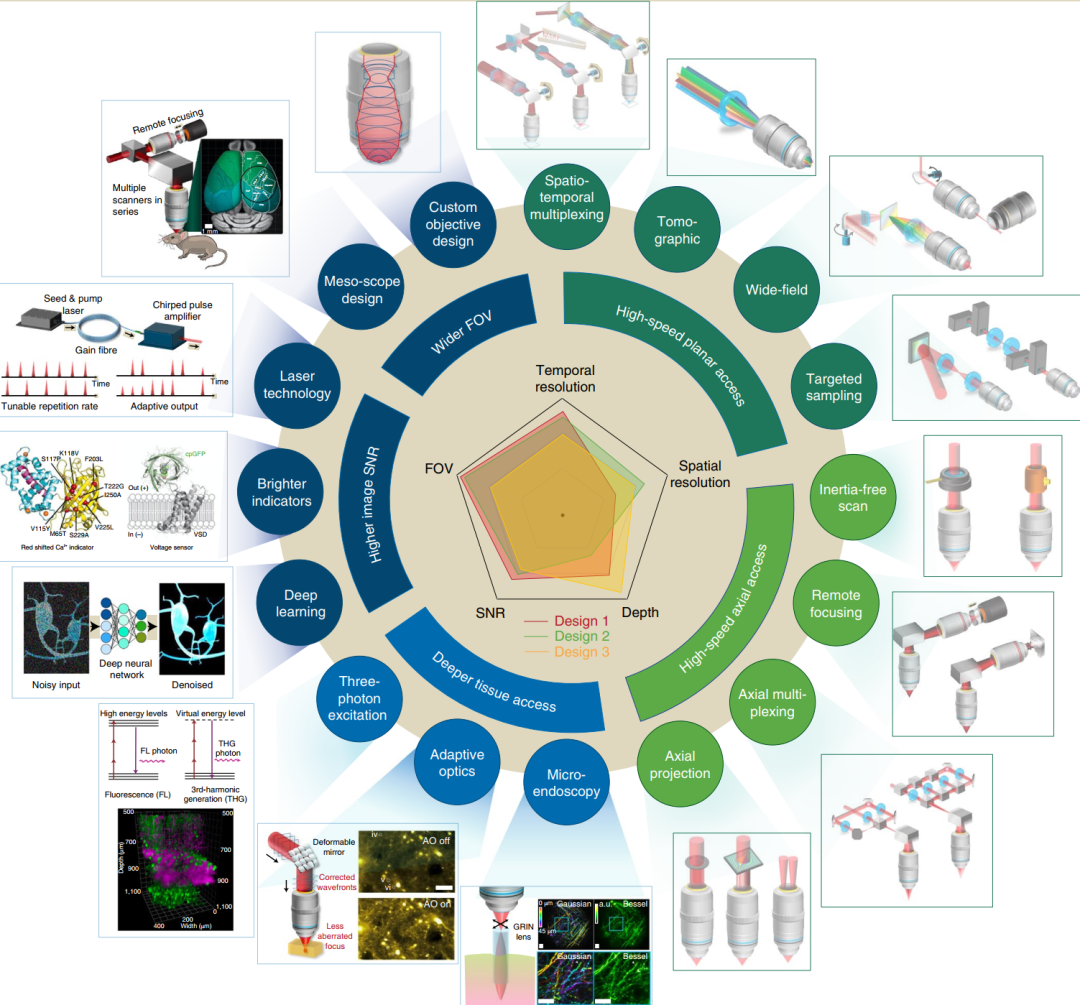
多光子显微镜在视场,信噪比,穿透深度,时空分辨率等多个维度的前沿进展
近年来, 多光子成像技术以其高空间分辨率、高穿透深度、低侵入性, 以及固有的光学层析能力等优点, 在生物医学领域已经取得了令人瞩目的成果. 传统的2PEF发展已较为成熟, 为了取得进一步突破, 多光子成像技术从实际的生物医学应用出发, 对传统2PEF在多色成像、功能成像、活体成像、成像深度等方面的不足进行了较大改进, 例如多色双光子激发荧光显微成像能在亚细胞水平实现多种标记荧光团的实时动态监测; 双光子FLIM技术可以在进行高分辨三维成像的同时获取生物组织的生化特性信息, 对生物组织功能和结构进行无标记精确定量表征; 双光子光纤内窥成像能深入体内进行深层组织器官成像, 且相较于普通内窥镜有着较高的分辨率, 能观察到生物组织内亚细胞结构; 三光子荧光显微成像相较2PEF穿透深度更深, 分辨率及信噪比也大大提高. 总之, 相比于传统2PEF, 这几种多光子成像技术在成像性能方面得到极大提升, 显著地拓宽了其在生物医学领域的应用范围. 然而, 受限于激光器、光纤、探测器等技术的发展, 多光子成像技术在生物医学领域的应用仍面临着巨大挑战. 例如, 多色双光子激发荧光显微成像技术存在系统复杂, 多种荧光团无法同时最优激发、双光子激发效率不高及光谱串扰等问题; 双光子FLIM技术则与2PEF技术相同, 也面临着穿透深度依旧受限的问题, 而且双光子FLIM系统较为复杂, 对光源和探测器等有严格要求, 成本昂贵. 再者, 受组织自身荧光信号强度和系统探测效率的限制, 双光子FLIM技术在数据的采集及处理上也十分繁琐耗时; 双光子光纤内窥成像虽然在向更小型化发展, 但对于活体内部组织器官实时成像而言系统尺寸仍不够小, 而且在探测上对样品发射的荧光的收集效率并不高; 三光子显微成像技术成像深度则是受限于光源能量不高, 而且目前用于三光子荧光显微成像的荧光探针数量较少, 且亮度有限. 未来随着激光技术的发展和光源能量利用的进一步提升, 多色双光子激发荧光显微成像、双光子FLIM和三光子荧光显微成像的激发效率与成像深度也会得到进一步提高; 而光纤技术在信号传输、小型化方面的进一步发展则能使多色双光子激发荧光显微成像、双光子光纤内窥成像、三光子成像的系统结构更加紧凑合理; MEMS技术的发展能使双光子光纤内窥成像系统尺寸更加紧凑; 更高信号探测效率的探测器的发展能提高双光子FLIM对样品的荧光采集效率, 数据采集处理技术的进步则能大大减少双光子FLIM的图像处理时间; 荧光探针技术的发展可以为多色双光子激发荧光显微成像及三光子荧光显微成像技术提供更多的标记选择, 开发量子效率更高的荧光探针也有助于提高多光子成像的深度. 此外, 不同种类的多光子成像技术的结合也能相互促进, 从而大大拓宽其应用范围, 可以预见, 随着科研人员的不懈努力, 未来激光、光纤、探测器、荧光探针等技术必将取得长足的发展, 由此促进多光子成像技术在生物医学应用上取得更多新进展.
多光子显微成像的应用
尽管显微镜技术历经了显微镜、荧光显微镜、共聚焦等阶段,但是对于神经科学的研究而言,不同成像技术均是重要的研究工具。其中多光子显微镜的光学层析能力、组织穿透力强,在神经科学研究中应用日益广泛 。
结构成像
多光子显微镜适用于亚细胞结构的高分辨率解析。早在2002年人们就已经运用双光子显微镜观察到,小鼠学习后,其桶状皮层神经元形成了新树突棘,说明神经元之间形成了新的连接,可作为新信息的承载结构。
追踪神经动态
多光子激发与荧光标记的搭配已经日趋成熟。已有诸多工作结合双光子显微成像技术和荧光钙指示剂及其他荧光成像标记物,对线粒体、神经元、胶质细胞、血管活动等进行动态成像。普通的双光子激发荧光显微镜可广泛应用于活细胞、类器官、活体动物(包括果蝇、斑马鱼、鼠、非人灵长类动物等)脑成像,甚至可以实现在6个月左右,对清醒状态下猕猴的皮层进行长时、多次成像。长期成像有助于追踪神经细胞的迁移、连接、衰老、凋亡等过程。另外,头戴式微型化双光子显微镜则便于实时监测小鼠自由活动过程中的神经动态变化。例如北京大学的研究人员于2012年,研发出重仅2.15克的头戴式微型化双光子显微镜,并利用该显微镜首次在小鼠进行清醒的行为活动中获取了大脑神经元乃至树突棘活动清晰稳定的图像 。此后,小动物的高分辨高速双光子成像系统可助力实际的生物自由行为场景下神经活动研究。
在高速成像方面,如电压成像,对于需要快速扫描的信号,可利用基于压力元件的声光偏转器随机扫描系统。此外,已实现三维大体积成像,以39赫兹采样率对250微米3的三维大脑空间进行单细胞分辨率的神经活动成像 [4]。由于光信噪比极限(采样速度越快,采集时间短以致采集到光子的个数越少,少到与随机噪声光子的级别时,便难以区分信号光子和噪音光子),高速成像的实现亟待更高光电转换效率采集工具与更高荧光强度指示剂的强强联手。
成像深度方面,目前双光子最深成像记录是1000微米(在多种成像条件优化情况下可实现)。但在不透明样品中,背景噪声随成像深度加深而加剧(类似于多层叠加虚化,有点像人眼散光看东西的效果——这句话仅仅是为了理解),存在严重的散射限制。相比于双光子,三光子更加适于更深处区域的成像。三光子吸收过程需要三个光子几近同时碰撞目标分子,所需的激光光子密度更高,而在非焦面,光子密度低,可避免不必要的光子的发射,抑制背景噪声能力更强。2013年,研究人员用1700纳米波段的三光子成像系统对完整小鼠海马体进行活体成像,深度达1200微米。此后该小组不断优化更新三光子显微镜的各个模块,于2020年开发了只对感兴趣区域(region of interest)进行激光照射的自适应飞秒激光源,大大降低了对功率的需求 。三光子系统也有与体积成像技术结合的版本,可对清醒活动小鼠在听觉皮层、海马等区域1毫米×1毫米×1.22毫米的体积内(包含约12 000个神经元)以17赫兹采样率进行单细胞分辨率的钙信号采集 。头戴式三光子对自由活动大鼠1120 微米深处的皮层神经元活动进行1小时以上的稳定钙成像。研究者们正努力拓展神经科学研究需求的应用边界。
大视场方面,由于动物行为过程中可能涉及多个脑区多重网络协作,对多区域神经网络活动同时、大规模地记录仍是脑科学发展的一大期待。科研人员始终在努力探索攻克这一难关的方法,除了发展高通量神经电极记录技术,大规模光学成像技术也是一个重要的突破口。2016年开发了一款强大的双光子介观显微镜,其成像视场达到5 毫米×5毫米,能够跨多个脑区进行高速功能成像。最近开发的大视场双路径扫描显微镜系统——DIESEL2p系统,在保持单细胞分辨率的前提下,视场可达5 毫米以上,而且能够实现通过两条相对独立的路径同步对两个区域进行成像。但这些工具只是针对小鼠大脑,很难满足对大鼠等更大型动物大脑的研究需求。
此外,激光对于活体组织有一定损伤,因此活体组织可承受的功率有限,这始终牵制着高时空分辨率成像的实现。在常规的激光扫描显微镜中,为了记录神经元的功能信息,传统方法是对整个成像区域进行激光扫描,再对图像处理筛选出神经元,得到其随时间的功能活动。这显然既浪费激光功率,也容易因功率过高引起鼠脑的损伤。正如在通信系统中,人们通过电话、电脑来实现点对点式精确高效的信息交流,一个新的思路是通过灵活的自适应光源(adaptive optical source)实现精准激发——在功能成像前预先确定目标成像区域,只针对感兴趣区域进行靶向激光照射,提高有限功率获取的有效信息量。
控制神经活动
除了可视化精细结构、监测神经动态外,双光子显微镜还可实现对神经活动进行时空精准的光遗传控制。2012年实现了对脑片上,躯体感觉皮质神经元的单根树突乃至单个树突棘(微米级细小空间结构)的激活。2018年,运用全息技术实现了对三维脑组织中80多个神经元活动的“读”(读取神经元活动)与“写”(光遗传控制神经活动)。还有一些研究者正努力将电生理等记录—刺激技术与多光子技术联合使用,探索更多富有挑战性的神经科学问题。